
【题目】中学化学涉及多种常数,下列说法正确的是( )
A.两种物质反应,不管怎样书写化学方程式,平衡常数不变
B.某温度下,2L密闭容器中加入4mol A和2mol B发生反应:
3A(g)+2B(g)![]() 4C(s)+2D(g)。平衡时测得n(C)=1.6mol,反应的化学平衡常数表达式为K=
4C(s)+2D(g)。平衡时测得n(C)=1.6mol,反应的化学平衡常数表达式为K=![]()
C.温度一定时,当溶液中c(Ag+ )· c(Cl-)等于Ksp值时,此溶液为AgCl的饱和溶液
D.难溶电解质AB2饱和溶液中,c(A2+ )=x mol·L﹣1,c(B—)=y mol·L﹣1,则Ksp值为4xy2
【答案】C
【解析】
试题分析:A、平衡常数是用生成物浓度的幂次方乘积除以反应物的幂次方乘积计算,和化学方程式书写有关,系数变化,平衡常数变化,故A错误;B、固体和液体不写入平衡常数表达式中,3A(g)+2B(g)![]() 4C(s)+2D( g).平衡常数K=
4C(s)+2D( g).平衡常数K= ,故B错误;C、沉淀溶解平衡状态下离子浓度幂次方乘积等于Ksp达到沉淀溶解平衡,形成饱和溶液,温度一定时,当溶液中(Ag+)c(Cl-)等于Ksp值时,此溶液为AgCl的饱和溶液,故C正确;D、沉淀溶解平衡状态下饱和溶液中离子浓度的幂次方乘积计算Ksp,AB2饱和溶液中AB2(s)
,故B错误;C、沉淀溶解平衡状态下离子浓度幂次方乘积等于Ksp达到沉淀溶解平衡,形成饱和溶液,温度一定时,当溶液中(Ag+)c(Cl-)等于Ksp值时,此溶液为AgCl的饱和溶液,故C正确;D、沉淀溶解平衡状态下饱和溶液中离子浓度的幂次方乘积计算Ksp,AB2饱和溶液中AB2(s)![]() A2+(aq)+2B-(aq),Ksp=c(A2+)c2(B-)=xy2,故D错误;故选C。
A2+(aq)+2B-(aq),Ksp=c(A2+)c2(B-)=xy2,故D错误;故选C。


科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是
A. Na2CO3+2HCl=Na2CO3+CO2↑+H2O B. H2O+CO2=H2CO3
C. 2Na2O2+2H2O=4NaOH+O2↑ D. 2Al(OH)3![]() Al2O3+3H2O
Al2O3+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g)![]() NH2COONH4(s) △H1
NH2COONH4(s) △H1
反应Ⅱ:NH2COONH4(s)![]() CO(NH2)2(s)+H2O(g) △H2= +72.49kJ/mol
CO(NH2)2(s)+H2O(g) △H2= +72.49kJ/mol
总反应:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) △H3= -86.98kJ/mol
CO(NH2)2(s)+H2O(g) △H3= -86.98kJ/mol
①反应Ⅰ的△H1=______________。
②一定温度下,在体积固定的密闭容器中按 n(NH3):n(CO2)=2:1 进行反应Ⅰ,下列能说明反应Ⅰ达到了平衡状态的是_______(填序号)。
A 容器内气体总压强不再变化
B NH3与CO2的转化率相等
C 容器内混合气体的密度不再变化
(2)在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
①该反应的化学平衡常数表达式为K=___________。
②该反应为____________(填“吸热”或“放热”)反应。
③某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为________℃。
④在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2 mol·L-1,c(H2)为1.5 mol·L-1,c(CO)为1 mol·L-1,c(H2O)为3 mol·L-1,此时反应向________(填“正向”或“逆向”)进行。
(3)工业上从废铅蓄电池废液回收铅的过程中,常用纯碱溶液与处理后的铅膏(主要含PbSO4)发生反应:PbSO4(s)+CO32-(aq)![]() PbCO3(s)+SO42-(aq)。已知溶度积常数:Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14,则该反应的化学平衡常数K =____。
PbCO3(s)+SO42-(aq)。已知溶度积常数:Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14,则该反应的化学平衡常数K =____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.在一定体积和一定条件下有反应N2(g)+3H2(g)![]() 2NH3(g),现分别从两条途径建立平衡:
2NH3(g),现分别从两条途径建立平衡:
Ⅰ.起始浓度N2:1 mol·L-1,H2:3 mol·L-1
Ⅱ.起始浓度N2:2 mol·L-1,H2:6 mol·L-1
则下列叙述正确的是( )
A. Ⅰ和Ⅱ两途径达到平衡时,体系内各成分的体积分数相同
B. 达到平衡时,途径Ⅰ的反应速率v(H2)等于途径Ⅱ的反应速率v(H2)
C. 达到平衡时,途径Ⅱ体系内混合气体的压强是途径Ⅰ内混合气体压强的2倍
D. 达到平衡时,途径Ⅰ体系内混合气体的密度为途径Ⅱ体系内混合气体的密度的
查看答案和解析>>
科目:高中化学 来源: 题型:
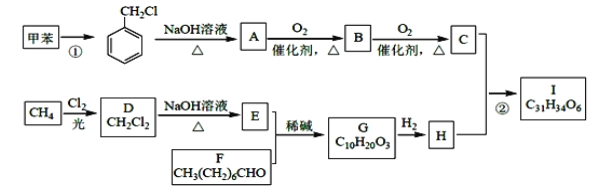
【题目】高血脂是一种常见的心血管疾病,治疗高血脂的新药I的合成路线如下:
已知:a、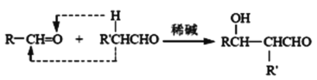
b、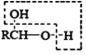
![]() RCHO
RCHO
回答下列问题:
(1)反应①所需试剂、条件分别是____________;A的化学名称为____________。
(2)②的反应类型是______________;A→B 的化学方程式为_________________。
(3)E的结构简式为______________;I 中所含官能团的名称是____________。
(4)化合物W 的相对分子质量比化合物C 大14,且满足下列条件①遇FeCl3 溶液显紫色;②能发生银镜反应,W 的可能结构有____种。其中核磁共振氢谱显示有5 种不同化学环境的氢,峰面积比为2:2:2:1:1,写出符合要求的W 的结构简式________。
(5)设计用甲苯和乙醛为原料制备 ![]() 的合成路线,其他无机试剂任选(合成路线常用的表示方式为A
的合成路线,其他无机试剂任选(合成路线常用的表示方式为A![]() B
B![]() 目标产物。____________
目标产物。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,![]() ,常温下
,常温下![]() 在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
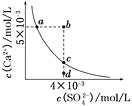
A.在任何溶液中,![]() 、
、![]() 均相等
均相等
B.b点将有沉淀生成,平衡后溶液中![]() 一定等于
一定等于![]()
C.a点对应的![]() 等于c点对应的
等于c点对应的![]()
D.d点溶液通过蒸发可以变到c点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是![]()
A.酸碱中和滴定时,滴定管和锥形瓶在使用前均需用待装液润洗
B.清洗碘升华实验所用试管,先用稀盐酸清洗,再用水清洗
C.实验室从海带提取单质碘的方法是:取样![]() 灼烧
灼烧![]() 溶解
溶解![]() 过滤
过滤![]() 萃取
萃取
D.配制![]() 溶液时未恢复至室温就转移并定容,所得溶液浓度偏小
溶液时未恢复至室温就转移并定容,所得溶液浓度偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示,有关该有机物的叙述不正确的是
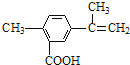
A. 在一定条件下,能发生取代、氧化和加聚反应
B. 该物质分子中最多可以有11个碳原子在同一平面上
C. 1 mol该物质最多可与5 mol H2发生加成反应
D. 1 mol该物质完全氧化最多可消耗13 mol氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)请用平衡移动原理解释Na2CO3能使溶液中Fe3+转化成氢氧化物沉淀的原因_______。
(2)取浓度相同的NaOH和HCl溶液,以3:2体积比相混合,所得溶液的pH等于12,则该原溶液的浓度(溶液的体积变化忽略不计)为____________。
(3)常温下,将0.1 mol·L-1 的氨水与0.1 mol·L-1的盐酸按一定体积混合。若两溶液混合后,所得溶液中 c(NH4+)=c(Cl-),混合后所得溶液中溶质的电离方程式为_______;水解离子方程式为_______。
(4)已知:Ksp(FeS)=6.5×10-18,Ksp(CuS)=1.3×10-36。向浓度均为0.1 mol·L-1的FeSO4和CuSO4的混合溶液中滴加Na2S溶液,当加入Na2S溶液至出现两种沉淀,则溶液中c(Fe2+) : c(Cu2+) =___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com