
下列离子方程式中,属于水解反应的是( )
A.HCOOH+H2O HCOO-+H3O+ HCOO-+H3O+ |
B.CO2+H2O HCO3-+H+ HCO3-+H+ |
C.CO32-+H2O HCO3-+OH- HCO3-+OH- |
D.HS-+H2O S2-+H3O+ S2-+H3O+ |
科目:高中化学 来源: 题型:单选题
下列液体均处于25℃,有关叙述正确的是
| A.某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐 |
| B.pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的102倍 |
| C.常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,该溶液中一定可以大量存在K+、Na+、AlO2-、SO42- |
| D.常温时,0.l mol/L HA溶液的pH>l,0.1 mol/L BOH溶液中c(OH-)/c(H+)=l012,将这两种溶液等体积混合,混合后溶液中离子浓度的大小关系为:c(B+)>c(OH-)>c(H+)>c(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某温度下,向pH=6的蒸馏水中,加入NaHSO4晶体,保持温度不变,测得溶液的pH为2 ,下列对该溶液的叙述中不正确的是
| A.该温度下加入等体积pH=12的NaOH溶液可使该溶液恰好呈中性 |
| B.由水电离出来的H+的浓度是1.0×10-10mol/L |
| C.加入NaHSO4晶体抑制了水的电离 |
| D.该温度高于25℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t℃时AgCl的Ksp=4×10-10。下列说法不正确的是( )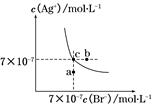
| A.在t℃时,AgBr的Ksp为4.9×10-13 |
| B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点 |
| C.图中a点对应的是AgBr的不饱和溶液 |
D.在t℃时,AgCl(s)+Br-(aq) AgBr(s)+Cl-(aq)平衡常数K≈816 AgBr(s)+Cl-(aq)平衡常数K≈816 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
| A.在任何溶液中,c(Ca2+)、c(SO42-)均相等 |
| B.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3 mol/L |
| C.a点对应的Ksp等于c点对应的Ksp |
| D.d点溶液通过蒸发可以变到c点 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
向50 mL 0.018 mol·L-1 AgNO3溶液中加入50 mL 0.02 mol·L-1盐酸。已知AgCl(s)的溶度积常数Ksp= 1×10-10,混合后溶液的体积变化忽略不计。下列说法不正确的是( )
| A.混合后,溶液中肯定有沉淀生成 |
| B.沉淀生成后溶液中Ag+的浓度为10-5 mol·L-1 |
| C.沉淀生成后溶液的pH=2 |
| D.混合后,升高温度,溶液中Ag+的浓度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知在常温下测得浓度均为0.1 mol·L-1的下列三种溶液的pH: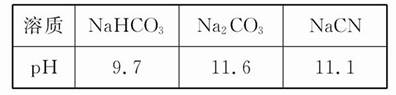
下列说法中正确的是( )
| A.阳离子的物质的量浓度之和:Na2CO3>NaCN>NaHCO3 |
| B.相同条件下的酸性:H2CO3<HCN |
| C.三种溶液中均存在电离平衡和水解平衡 |
D.升高Na2CO3溶液的温度,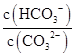 减小 减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列各溶液中,pH最大的是( )
| A.pH=9的氨水稀释1 000倍 |
| B.pH=9的烧碱溶液稀释1 000倍 |
| C.pH=5的盐酸稀释1 000倍 |
| D.pH=5的氯化铵溶液稀释1 000倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是( )
| A.100 ℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性 |
| B.室温下,向pH=3的醋酸溶液加水稀释后,溶液中所有离子浓度均 减小 |
| C.向含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 |
| D.向CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com