
现有三组实验:①除去混在植物油中的水②回收碘的CCl4溶液中的CCl4③用食用酒精浸泡中草药提取其中的有效成分。分离以上混合液的正确方法依次是
A. 分液、萃取、蒸馏 B. 萃取、蒸馏、分液
C. 分液、蒸馏、萃取 D. 蒸馏、萃取、分液
科目:高中化学 来源:2016-2017学年浙江省台州市高一上学期期末质量评估考试化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值,下列叙述中不正确的是
A. 0.1molNaCl固体中含0.1NA个阳离子
B. 22.4LCO2含有的原子数是3NA
C. 常温常压下,NA个H2质量为2g
D. 1molMg与足量O2反应,失去的电子数是2NA
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高二下学期开学考试化学试卷(解析版) 题型:选择题
已知反应:①101kPa时,C(s) + 1/2O2(g)=CO(g) △H1=-110.5kJ/mol
②稀溶液中,H+(aq) + OH-(aq)=H2O(1) △H2=-57.3kJ/mol
下列结论正确的是( )
A. 若碳的燃烧热用△H3来表示,则△H3<△H1
B. 若碳的燃烧热用△H3来表示,则△H3>△H1
C. 浓硫酸与稀NaOH溶液反应的中和热为57.3kJ/mol
D. 稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高一下学期第一次模块考试化学试卷(解析版) 题型:选择题
将12mol/L的盐酸(ρ=1.19g/cm3)50mL稀释成6mol/L的盐酸(ρ=1.10g/cm3),需加水的体积为( )
A. 50mL B. 50.5mL C. 55mL D. 59.5mL
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高一下学期第一次模块考试化学试卷(解析版) 题型:选择题
下列对于“摩尔”的理解正确的是( )
A. 10mol氧约含有6.02×1024个氧分子 B. NA 约等于6.02×1023
C. 摩尔是国际科学界广泛使用的一种物理量 D. 摩尔是物质的量的单位,简称摩,符号为mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省大连市高二上学期期末考试(理)化学试卷(解析版) 题型:简答题
根据下列电化学装置,回答下列问题:
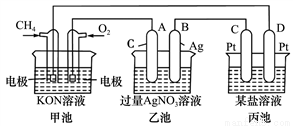
(1)图中甲、乙池的名称:甲池是__________装置,乙池是__________装置。(填“原电池”或“电解池”)
(2)A(石墨)电极的名称是____________。
(3)通入CH4一极的电极反应式为___________________________________。
(4)乙池中的电解方程式为___________________________________________。
(5)当乙池中B极的质量增加5.4 g时,甲池中理论上消耗O2_____mL(标准状况下)。此时丙池某电极析出1.6 g某金属,则丙池溶液中的溶质可能是___________(填序号)。
A.MgSO4 B.CuSO4 C.Na2SO4
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省大连市高二上学期期末考试(理)化学试卷(解析版) 题型:选择题
关于下列装置的说法,正确的是
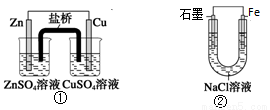
A. 装置①中,盐桥中的K+移向CuSO4溶液
B. 装置①中,Zn为负极,发生还原反应
C. 装置②中的Fe发生析氢腐蚀
D. 装置②中电子由Fe流向石墨,然后再经溶液流向Fe
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三适应性月考(五)理综化学试卷(解析版) 题型:实验题
氯化亚铜(CuCl)广泛用于化工、印染、有机合成等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产氯化亚铜的工艺过程如下图所示。

回答下列问题:
(1)CuCl中Cu元素在周期表中的位置为___________。
(2)步骤①中N元素被还原为最低价,则Cu溶解的离子方程式为________。溶解温度应控制在60~70℃,原因是______________。
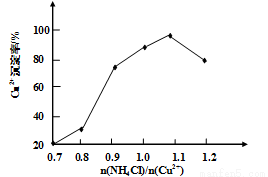
(3)写出步骤③中主要反应的离子方程式________。(NH4)2SO3要适当过量,目的有:保证Cu2+的还原速率,__________。已知NH4Cl、Cu2+的物质的量之比 与Cu2+沉淀率的关系如图所示,当氯化铵用量增加到一定浓度后氯化亚铜的沉淀率减少,原因是________。
与Cu2+沉淀率的关系如图所示,当氯化铵用量增加到一定浓度后氯化亚铜的沉淀率减少,原因是________。
(4)步骤⑥加入乙醇洗涤的目的是__________。
(5)氯化亚铜的定量分析:
①称取样品0.250g和10mL过量的FeCl3溶液于250mL锥形瓶中,充分溶解;
②用0.100mol·L-1硫酸铈[Ce(SO4)2]标准溶液测定。已知:CuCl+FeCl3=CuCl2+FeCl2、Fe2++Ce4+=Fe3++Ce3+。
三次平衡实验结果如下表(平衡实验结果相差不能超过1%):
平衡实验次数 | 1 | 2 | 3 |
0.250g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 |
则样品中CuCl的纯度为_______(结果保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源:2017届湖南省衡阳市高三第二次质检化学试卷(解析版) 题型:选择题
下列化学用语表示正确的是
A. Mg2+的结构示意图: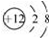 B. 葡萄糖的结构简式:C6H12O6
B. 葡萄糖的结构简式:C6H12O6
C. H2O2的电子式: D. 硫酸的电离方程式:H2SO4═H22++SO42﹣
D. 硫酸的电离方程式:H2SO4═H22++SO42﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com