
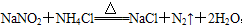 ,关于该反应的说法正确的是( )
,关于该反应的说法正确的是( )| A.生成1 molN2时转移的电子为6 mol | B.NaNO2是氧化剂 |
| C.NH4Cl中的N元素被还原 | D.N2既是氧化剂又是还原剂 |
科目:高中化学 来源:不详 题型:实验题
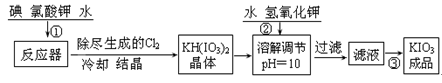
| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 8.08 | 12.6 | 18.3 | 24.8 |
| 操作步骤 | 实验现象 |
| 取1g纯净的NaCl,加3mL水配成溶液。 | 溶液无变化 |
| 滴入5滴淀粉溶液和1mL 0.1mol/L KI溶液,振荡。 | 溶液无变化 |
| 然后再滴入1滴1mol/L的H2SO4,振荡。 | 溶液变蓝色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
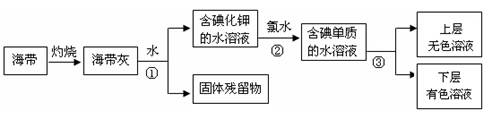

 ( )NaOH+H2↑+( )( )。
( )NaOH+H2↑+( )( )。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
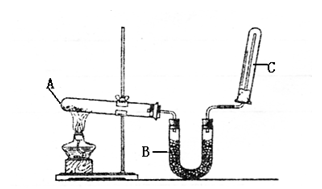
| A.a1=2a2 | B.2a2>a1 | C.a1>2a2 | D.无法确定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
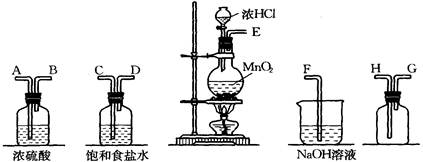
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用澄清石灰水鉴别Na2CO3溶液和NaHCO3溶液 |
| B.用点燃的方法除去CO2中的CO |
| C.用加热法除去Na2CO3溶液中的NaHCO3 |
| D.用品红溶液或酸性KMnO4溶液鉴别 CO2和SO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
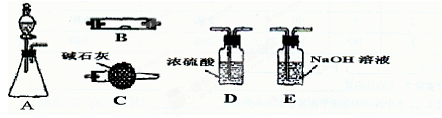
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 (9分)已知NH3与CuO在加热条件下可生成N2,方程式为2NH3+3CuO3Cu+N2+3H2O。纯氮气跟镁在高温下反应可得到氮化镁,氮化镁遇水反应可生成氢氧化镁和氨气。
(9分)已知NH3与CuO在加热条件下可生成N2,方程式为2NH3+3CuO3Cu+N2+3H2O。纯氮气跟镁在高温下反应可得到氮化镁,氮化镁遇水反应可生成氢氧化镁和氨气。

| A.硫酸铵固体与消石灰共热 | B.浓氨水逐滴加到新制的生石灰中 |
| C.在一定条件下,氮气与氢气化合 | D.加热分解氯化铵固体 |
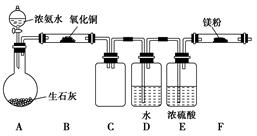
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 CaCl2 + 2NH3↑+ 2H2O
CaCl2 + 2NH3↑+ 2H2O
 气泄漏事件,500 多居民深夜大转移。假如你在现场,你会采用什么自救为法? 。
气泄漏事件,500 多居民深夜大转移。假如你在现场,你会采用什么自救为法? 。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com