
计算:(1)20 mL这种溶液中的FeCl3与多少毫升5 mol·L-1的FeCl3溶液中所含FeCl3的物质的量相等?
(2)反应后溶液中Fe2+的物质的量浓度为多少?
解析:在该反应中,Fe、Cu都是还原剂,被腐蚀的Cu为0.05 mol,投入的Fe粉也为0.05 mol,因此铁粉只可能恰好完全反应或不足,最后剩余的1.6 g不溶物一定为铜。由于Fe3+得电子数等于Fe和Cu的失电子总数,
则:n(Fe3+)=2×n(Fe)+2×n(Cu)=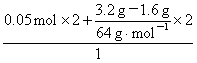 =0.15 mol。
=0.15 mol。
(1)由于两溶液中溶质的物质的量相等,则5 mol·L-1的FeCl3溶液的体积V(FeCl3)=![]() =0.03 L,V(FeCl3)=30.0 mL。
=0.03 L,V(FeCl3)=30.0 mL。
(2)2Fe3+ + Cu === 2Fe2++Cu2+
2 mol 1 mol 2 mol
0.1 mol 0.05 mol n1
2Fe3+ + Fe === 3Fe2+
2 mol 1 mol 3 mol
(0.15-0.1)mol 0.025 mol n2
Fe+Cu2+===Fe2++Cu
1 mol 1 mol
n3 ![]() =0.025 mol
=0.025 mol
所以溶液中n(Fe2+)=n1+n2+n3=0.1 mol+0.075 mol+0.025 mol=0.2 mol,
c(FeCl2)=![]() =10 mol·L-1
=10 mol·L-1
也可以根据溶液中电荷守恒来计算:
2n(Fe2+)+2n(Cu2+)=n(Cl-)
n(Fe2+)=![]() =0.2 mol
=0.2 mol
c(FeCl2)=![]() =10 mol·L-1
=10 mol·L-1
或根据铁元素质量守恒来计算:
n(Fe2+)=n(Fe3+)+n(Fe)=0.15 mol+![]() =0.2 mol
=0.2 mol
c(FeCl2)= ![]() =10 mol·L-1
=10 mol·L-1
答案:(1)V(FeCl3)=30 mL
(2)c(FeCl2)=10 mol·L-1


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:038
用20 mL FeCl3溶液腐蚀3.2 g Cu片,将Cu片完全腐蚀后,加入铁粉2.8g ,反应后溶液中存在不溶物1.6g(设反应前后溶液体积变化忽略不计)。
计算:⑴20 mL这种溶液中的FeCl3与多少毫升5 mol•L-1的FeCl3溶液中所含FeCl3的物质的量相等?
⑵反应后溶液中Fe2+的物质的量浓度为多少?
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:038
计算:⑴20 mL这种溶液中的FeCl3与多少毫升5 mol•L-1的FeCl3溶液中所含FeCl3的物质的量相等?
⑵反应后溶液中Fe2+的物质的量浓度为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
A.3.6 g B.2.4 g C.1.2 g D.0.6 g
查看答案和解析>>
科目:高中化学 来源:2012-2013学年黑龙江省牡丹江一中高一上学期期末考试化学试卷(带解析) 题型:单选题
分别用20 mL 1mol/L BaCl2溶液恰好可使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液的物质的量浓度之比是( )
| A.3∶2∶2 | B.1∶2∶3 | C.1∶3∶3 | D.3∶1∶1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com