
【题目】某研究性学习小组设计了一组实验来探究元素周期律。
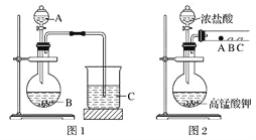
甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素非金属性强弱比较的实验研究;
乙同学设计了如图2装置来验证卤族元素性质的递变规律,A、B、C三处分别是蘸有溴化钠溶液的棉花、湿润的淀粉碘化钾试纸、湿润的红色纸条。
已知常温下浓盐酸与高锰酸钾能反应生成氯气;
可选择的试剂有:大理石、碳酸钠粉末、浓盐酸、稀硝酸、硅酸钠溶液。
(1)甲同学实验中(图1):
①从给出试剂中选出最佳物质(填化学式):A________,B________。
②烧杯C中发生反应的离子方程式为__________________________。
(2)乙同学实验中(图2):
①写出A处反应的离子方程式________________________。
②B处实验现象是________________________。
③若高锰酸钾的还原产物为Mn2+,当有0.04 mol高锰酸钾参加反应时,则可生成标准状况下的氯气的体积为______________________。
【答案】HNO3 CaCO3 CO2+SiO32-+H2O===H2SiO3↓+CO32- Cl2+2Br-===Br2+2Cl- 试纸变蓝 2.24 L
【解析】
(1)根据信息知道:甲同学根据元素非金属性与对应最高价含氧酸之间的关系如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较,根据强酸制弱酸来回答即可;
(2)根据氧化性强的单质可以将氧化性弱的单质从其盐中置换出来结合反应产物确定实验现象,根据化学方程式计算氯气体积,或者得失电子数相等列关系式计算。
(1)甲同学实验中(图1):
①根据题干信息:甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素非金属性强弱比较的实验研究,硝酸的酸性强于碳酸,碳酸酸性强于硅酸,最高价氧化物对应水化物酸性越强,则原子的非金属性越强,所以A为稀硝酸,B为碳酸钙,C为硅酸钠;
答案: HNO3 CaCO3
②图1烧杯中为二氧化碳与硅酸钠反应生成硅酸沉淀和碳酸钠,其反应的离子方程式为:SiO32-+CO2+H2O═H2SiO3↓+CO32-;
答案:CO2+SiO32-+H2O===H2SiO3↓+CO32-
(2)乙同学实验中(图2):
①根据题干信息:乙同学设计了如图装置来验证卤族元素性质的递变规律,所以乙同学的实验原理是同主族单质氧化性越强阴离子还原性越弱,对应元素非金属越强,高锰酸钾和浓盐酸反应会产生氯气,氯气具有氧化性,能将溴离子,碘离子氧化为对应的,即A处:Cl2+2Br-=2Cl-+Br2;
答案:Cl2+2Br-=2Cl-+Br2。
②B处反应:Cl2+2I-=2Cl-+I2,所以B处的现象变蓝,剩余的氯气能使湿润红纸褪色;
答案:试纸变蓝
③若高锰酸钾的还原产物为Mn2+,当有0.04 mol高锰酸钾参加反应时,则可生成标准状况下的氯气的体积为______________________。
根据得失电子数相等列关系式:设氯气生成nmol
2KMnO4~5Cl2
2mol 5mol
0.04mol nmol
n=![]() =0.1mol
=0.1mol
V=nVm=0.1mol×22.4L/mol=2.24L;
答案:2.24L。


科目:高中化学 来源: 题型:
【题目】目前汽车上使用的电瓶大多仍是铅蓄电池,其构造示意图如下。发生反应的化学方程式为:Pb(s)+PbO2(s)+2H2SO4(aq)![]() 2PbSO4(s)+2H2O(l),下列说法不正确的是
2PbSO4(s)+2H2O(l),下列说法不正确的是
A. 放电时,电解质溶液的pH值增大
B. 放电时,电路中转移0.2mol电子时Pb电极质量减少20.7g
C. 放电时,溶液中H+向PbO2电极移动
D. 放电时,正极反应为:PbO2(s)+4H+(aq)+SO42-(aq)+2e-=PbSO4(s)+2H2O(l)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏伽德罗常数的值为NA。下列说法正确的是
A.18 g H2O、D2O组成的物质中含有的电子数为10NA
B.0.2 mol铁在足量的氧气中燃烧,转移电子数为0.6NA
C.50 mL 12 mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA
D.0.1 mol 熔融的KHSO4中含有0.1NA个阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝粉和氧化铁粉末的混合物制成的铝热剂可用于焊接钢轨。现取不同质量的该铝热剂分别和100ml同物质的量浓度的NaOH溶液反应,所取铝热剂的质量与产生气体的体积关系如下表(气体体积均在标准状况下测定):
① | ② | ③ | ④ | |
铝热剂质量/g | 5g | 10g | 15g | 20g |
气体体积/L | 2.24L | 4.48L | 6.72L | 6.72L |
试完成下列计算:
(1)NaOH溶液的物质的量浓度_______________。
(2)该铝热剂中铝的质量分数_____________
(3)20g该铝热剂发生铝热反应理论上产生铁的质量是多少?________(写出步骤)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属和金属单质以及相关化合物有着广泛的应用,回答下列相关问题:
(1)铜或铜盐的焰色反应为绿色,下列有关原理分析的叙述正确的是______(填字母)。
a. 电子从基态跃迁到较高的激发态 b. 电子从较高的激发态跃迁到基态
c. 焰色反应的光谱属于吸收光谱 d. 焰色反应的光谱属于发射光谱
(2)In元素基态原子的价电子排布式为________。与Cu元素同周期,且基态原子有2个未成对电子的过渡元素是____(填元素符号)。
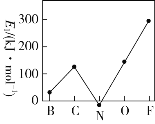
(3)第一电子亲和能(E1)是元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量。第二周期部分元素的E1变化趋势如图所示。试分析碳元素的E1较大的原因:______________。
(4)[PtCl4(NH3)2]中H-N-H键之间的夹角____(填“>”“<”或“=”)NH3分子中H-N-H键之间的夹角,原因是________________。
(5)铁、镍易与CO作用形成羰基配合物Fe(CO)5、Ni(CO)4。1个Fe(CO)5分子中含有σ键数目为____;已知Ni(CO)4分子为正四面体构型,下列溶剂能够溶解Ni(CO)4的是____(填字母)。
A. 四氯化碳 B.苯 C.水 D.液氨
(6)Fe3O4晶体中,O2-的重复排列方式如图所示,该排列方式中存在着由如1、3、6、7的O2-围成的正四面体空隙和由3、6、7、8、9、12的O2-围成的正八面体空隙。Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则Fe3O4晶体中,正四面体空隙数与O2-数之比为____。Fe3O4晶胞中有8个图示结构单元,晶体密度为5.18 g·cm-3,则该晶胞参数a=_____cm(写出计算表达式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示实验,回答问题:
(1)实验① 观察到的现象是________________________。实验②
观察到的现象是________________________。实验② 观察到的现象是________________________。
观察到的现象是________________________。
(2)实验③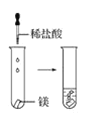 观察到的现象是________________________。实验④
观察到的现象是________________________。实验④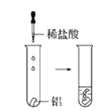 观察到的现象是________________________。
观察到的现象是________________________。
(3)由上述实验,你能得出的结论是________________________。
(4)请总结同周期元素金属性的变化规律__________,并用原子结构解释其原因_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与科学、技术、社会、环境密切相关,下列说法正确的是( )
A.SiO2具有导电性,可用于制作光导纤维和光电池
B.煤经过气化和液化等物理变化可转化为清洁燃料
C.乙酰胺(![]() )与甘氨酸的化学性质相同
)与甘氨酸的化学性质相同
D.屠呦呦用乙醚从青蒿中提取出对治疗疟疾有特效的青蒿素,该过程包括萃取操作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1200℃时,天然气脱硫工艺中会发生下列反应
①H2S(g)+![]() O2(g)=SO2(g)+H2O(g) ΔH1 ②2H2S(g)+SO2(g)=
O2(g)=SO2(g)+H2O(g) ΔH1 ②2H2S(g)+SO2(g)=![]() S2(g)+2H2O(g) ΔH2
S2(g)+2H2O(g) ΔH2
③H2S(g)+![]() O2(g)=S(g)+H2O(g) ΔH3 ④2S(g)=S2(g) ΔH4
O2(g)=S(g)+H2O(g) ΔH3 ④2S(g)=S2(g) ΔH4
则ΔH4的正确表达式为
A.ΔH4=![]() (ΔH1+ΔH2-3ΔH3)B.ΔH4=
(ΔH1+ΔH2-3ΔH3)B.ΔH4=![]() (3ΔH3-ΔH1-ΔH2)
(3ΔH3-ΔH1-ΔH2)
C.ΔH4=![]() (ΔH1+ΔH2-3ΔH3)D.ΔH4=
(ΔH1+ΔH2-3ΔH3)D.ΔH4=![]() (ΔH1-ΔH2-3ΔH3)
(ΔH1-ΔH2-3ΔH3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水化学资源开发利用的部分过程如图所示,下列说法正确的是( )
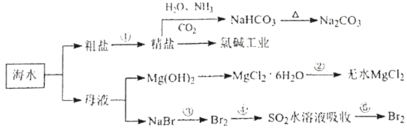
A.用澄清的石灰水可鉴别NaHCO3和Na2CO3
B.从海水中得到粗盐主要是通过蒸发操作实现的
C.在步骤③,中可通入Cl2使溴离子被还原为Br2
D.在步骤④中,SO2水溶液吸收Br2后,溶液的pH增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com