
实验室可用K2Cr2O7固体与浓盐酸混合加热制备氯气(K2Cr2O7被还原为Cr3+)。
(1)K2Cr2O7与浓盐酸反应的化学方程式为_______;若反应中转移3 mol e-,则消耗_______mol K2Cr2O7
(2)稀盐酸与K2Cr2O7固体混合加热没有氯气生成。为探究影响氯气生成的因素,某化学兴趣小组进行如下实验:
①提出假设
假设1:Cl-浓度对反应有影响;
假设2:H+浓度对反应有影响;
假设3: _____________________。
②设计实验方案,进行实验。写出实验步骤及预期现象和结论。
限选举实验试剂:浓盐酸、稀盐酸、浓硫酸、NaOH溶液、K2Cr2O7固体、NaCl固体、湿润的淀粉KI试纸
|
实验步骤 |
预期现象和结论 |
|
步:1:向盛有K2Cr2O7固体的A、B两试管中分别加入一定量的稀盐酸。 |
|
|
步骤2: |
|
|
步骤3: |
|
(1)K2Cr2O7+14HCl(浓) 2KCl+2CrCl3+3Cl2↑+7H2O
0.5
2KCl+2CrCl3+3Cl2↑+7H2O
0.5
(2)①Cl-浓度、H+ 浓度对反应都有影响
②
|
步骤2:向A试管中加入适量NaCl固体,加热,把湿润的淀粉KI试纸放在试管口附近 |
㈠若试纸变蓝,则假设1成立; ㈡若试纸未变蓝,则假设2或3成立 |
|
步骤3:向B试管中加入适量浓硫酸,加热,把湿润的淀粉KI试纸放在试管口附近 |
㈠若试纸变蓝,则假设2成立 ㈡若试纸未变蓝,结合步骤2中的㈡,则假设3成立 |
(其它合理答案也可给分)
【解析】
试题分析:(1)根据题意,Cr被还原为Cr3+,Cl-被氧化为Cl2,然后依据氧化还原反应电子得失守恒和原子守恒可写出方程式。依据方程式,消耗1mol K2Cr2O7转移电子6mol,转移3mol电子时消耗0.5mol K2Cr2O7。
(2)①根据假设1和假设2,假设3应为假设1、2的综合。
②依据假设,可知步骤一为对照实验标准,步骤二、三应分别改变氯离子浓度、氢离子浓度,改变氯离子浓度可通过加入NaCl实现,改变氢离子浓度可通过加入浓硫酸实现。然后用湿润的淀粉KI实质检验是否产生Cl2。
考点:考查氧化还原反应方程式书写及计算,化学实验原理,实验设计,化学实验操作等。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| 80℃-90℃ |



| 1 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
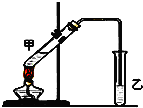 俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程.请回答下列问题:
俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com