
【题目】在2L的恒容密闭容器中充入A(g)和B(g),发生反应:A(g)+B(g)![]() 2C(g)+D(s)
2C(g)+D(s)
△H=a kJ/mol实验内容和结果分别如下表和右图所示。下列说法正确的是
实验 序号 | 温度 | 起始物质的量 | 热量变化 | |
A | B | |||
Ⅰ | 600℃ | 1mol | 3mol | 96kJ |
Ⅱ | 800℃ | 1.5mol | 0.5mol | - |
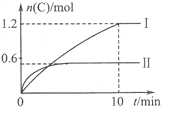
A. 实验Ⅰ中,10min内平均速率v(B)=0.06mol/(L·min);
B. 上述方程式中a=-160
C. 600℃时,该反应的平衡常数是1.5
D. 向实验Ⅱ的平衡体系中再充入0.5molA和1.5molB,A的转化率减小
【答案】BC
【解析】
A、图象分析可知实验Ⅰ中,10 min内C生成了1.2mol,结合化学反应速率v=△c/△t计算,速率之比等于化学方程式计量数之比,以此计算B的反应速率;
B、根据图象中的变化量结合图表中热量变化计算,依据化学平衡三段式可知,
A(g)+B(g)![]() 2C(g)+D(s) △H=a kJ/mol,
2C(g)+D(s) △H=a kJ/mol,
起始量(mol) 1 3 0 0
变化量(mol) 0.6 0.6 1.2 0.6 96kJ
平衡量(mol) 0.4 2.4 1.2 0.6
反应焓变是指1molA全部反应的热量变化;
C、结合B中化学平衡三段式列式计算平衡浓度,c(A)=0.2mol·L-1,c(B)=1.2mol·L-1,c(C)=0.6mol·L-1,平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积;
D、反根据等效平衡分析判断,反应前后气体体积不变,等比等效分析.
A、.10 min内C生成了1.2mol,则反应速率v(C)=1.2mol/(2L×10min)==0.06mol·L-1·min-1,速率之比等于化学方程式计量数之比,v(B)=1/2 v(C)=0.06mol·L-1·min-1×1/2=0.03mol·L-1·min-1,故A 错误;
B、根据图象中的变化量结合图表中热量变化计算,依据化学平衡三段式可知,
A(g)+B(g)![]() 2C(g)+D(s) △H=a kJ/mol,
2C(g)+D(s) △H=a kJ/mol,
起始量(mol) 1 3 0 0
变化量(mol) 0.6 0.6 1.2 0.6 96kJ
平衡量(mol) 0.4 2.4 1.2 0.6
反应焓变是指1molA全部反应的热量变化,则a=96kJ/0.6mol=160kJ·mol-1,图象分析,先拐先平温度高,温度越高C物质的量越小,温度升高,平衡逆向进行,说明反应是放热反应,所以a=-160kJ·mol-1。故B正确;
C、由B中可知平衡浓度:c(A)=0.2mol·L-1,c(B)=1.2mol·L-1,c(C)=0.6mol·L-1,平衡常数K=0.62/0.2×1.2=1.5,故C正确;
、反应前后气体体积不变,等比等效,开始投入量 A与B的物质的量之比为3:1,向实验Ⅱ的平衡体系中再充0.5 mol A和1.5 mol B,可以看作先投入0.5 mol A和0.5/3 mol B,两个平衡为等效平衡,再把剩余的B加入。增大B的浓度使平衡向正反应方向移动,则A的转化率增大,故D错误;
故选BC。


科目:高中化学 来源: 题型:
【题目】从经济效益和环境保护的观点出发,由铜制取硝酸铜最适宜的方法是
A. Cu与浓HNO3―→Cu(NO3)2
B. Cu与稀HNO3―→Cu(NO3)2
C. Cu![]() CuO
CuO![]() Cu(NO3)2
Cu(NO3)2
D. Cu+AgNO3―→Cu(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴酸银(AgBrO3)溶解度随温度变化曲线如图3-4-2所示。下列说法错误的是( )
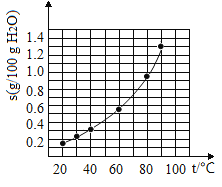
A. 溴酸银的溶解是放热过程
B. 温度升高时溴酸银的溶解速率加快
C. 60℃时溴酸银的Ksp约等于6×10-4
D. 若硝酸钾中含有少量溴酸银,可用重结晶方法提纯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 25℃时,0.1 mol·L-1CH3COOH溶液加水稀释后,c(OH-)/c(CH3COOH)减小
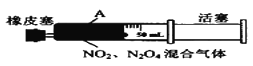
B. 将下图中的活塞快速推至A处固定,气体颜色先变深、再变浅,但比起始时深
C. 室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,溶液pH>7
D. SiO2(s)+2C(s)=Si(s)+2CO(g)只能在高温下自发进行,则该反应△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷![]() 是第四周期ⅤA族元素,可以形成
是第四周期ⅤA族元素,可以形成![]() 、
、![]() 、
、![]() 、
、![]() 等 化合物,有着广泛的用途
等 化合物,有着广泛的用途![]() 回答下列问题:
回答下列问题:
(1)写出砷的原子序数______________
(2)工业上常将含砷废渣![]() 主要成分为
主要成分为![]() 制成浆状,通入
制成浆状,通入![]() 氧化,生成
氧化,生成![]() 和单质硫
和单质硫![]() 写出发生反应的化学方程式 _____________________________________________
写出发生反应的化学方程式 _____________________________________________ ![]() 该反应需要在加压下进行,原因是 _______________________________________
该反应需要在加压下进行,原因是 _______________________________________
(3)已知:![]()
![]()
![]()
则反应![]() 的
的![]() ________________________
________________________
(4)![]() 时,将
时,将![]() 、
、![]()
![]() 和20mLNaOH溶液混合,发生反应:
和20mLNaOH溶液混合,发生反应:![]() 溶液中
溶液中![]() 与反应时间
与反应时间![]() 的关系如图所示.
的关系如图所示.
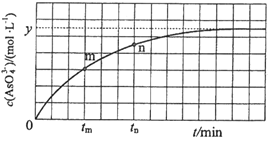
①下列可判断反应达到平衡的是 ______ ![]() 填标号
填标号![]() .
.
![]() 溶液的pH不再变化
溶液的pH不再变化 ![]()
![]()
![]() 不再变化
不再变化 ![]()
![]()
②![]() 时,
时,![]() ______
______![]() 填“大于”“小于”或“等于”
填“大于”“小于”或“等于”![]()
③![]() 时,
时,![]() ______
______![]() 时
时![]() 填“大于”“小于”或“等于”
填“大于”“小于”或“等于”![]() ,理由是 ____________________
,理由是 ____________________
④若平衡时溶液的![]() ,则该反应的平衡常数K为 ______________
,则该反应的平衡常数K为 ______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
A.充电时阳极反应:Ni(OH)2 -e— + OH- = NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com