
下面关于化学反应的限度的叙述中,正确的是
A.化学反应的限度都相同
B.可以通过改变温度控制化学反应的限度
C.可以通过延长化学反应的时间改变化学反应的限度
D.当一个化学反应在一定条件下达到限度时,反应即停止
科目:高中化学 来源:2013-2014学年上海市闵行区高三二模化学试卷(解析版) 题型:选择题
已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH值:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
下列说法或表达中,正确的是
A.少量二氧化碳通入NaClO溶液中:2NaClO + CO2 + H2O Na2CO3 + 2HClO
Na2CO3 + 2HClO
B.过量的 HCN滴入碳酸钠溶液中 HCN + Na2CO3 NaCN+ NaHCO3
NaCN+ NaHCO3
C.结合质子能力由强到弱的顺序为:CO32—>CN—>HCO3—>CH3COO—
D.常温下电离常数:Ki2(H2CO3)>Ki(C6H5OH)>Ki(HCN)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市徐汇、松江、金山三区高三二模化学试卷(解析版) 题型:选择题
下列物质都具有较强的吸水性。欲使稀硝酸成为浓硝酸,不能使用的试剂是
A.浓硫酸 B.五氧化二磷 C.无水硫酸镁 D.甘油
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市高一下学期期中考试化学试卷(解析版) 题型:选择题
下列关于有机物的叙述中,不正确的是
A.烷烃的同系物的分子式可用通式CnH2n+2表示
B.互为同系物的有机物也互为同分异构体
C.两个同系物之间的相对分子质量差为14或14的整数倍
D.同分异构体间具有相似的化学性质
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市高一下学期期中考试化学试卷(解析版) 题型:选择题
两种微粒含有相同的质子数和电子数,这两种微粒的关系可能是:(1)同一元素的不同原子,(2)不同元素的原子,(3)两种不同的分子,(4)一种原子和一种分子,(5)一种原子和一种离子,(6)一种分子和一种离子,(7)两种不同的阳离子,(8)两种不同的阴离子,(9)一种阴离子和一种阳离子,其中正确的是
A.(1)(3)(4)(7)(8) B.(1)(2)(5)(7)(9)
C.(1)(2)(5)(7)(9) D.(1)(2)(3)(4)(5)
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市高一下学期期中考试化学试卷(解析版) 题型:选择题
已知A、B两元素的原子序数在3~20之间,它们可形成离子化合物AmBn,若A的原子序数为a,则B的原子序数不可能为
A.a+8-m-n B. a-16-m-n C.a+16-m-n D.a-m-n
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市红桥区高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
(14分)A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中B与C同周期,D与E和F同周期,A与D同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的主族元素。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。
请回答下列问题。
(1)元素D在周期表中的位置 。
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示) 。
(3)若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式: 。
(4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式: 。冶炼金属E时,用石墨做电极。E在(填“阴”或“阳”) 极得到,电解过程中,阳极石墨需要不断补充,结合电极反应说明其原因是 。
(5)由A、B、C三种元素以原子个数比4:2:3形成化合物X,X中所含化学键类型有 。土壤中含有X中的阳离子在硝化细菌的催化作用下被氧气氧化为其阴离子,写出其离子方程式: 。
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市河北区高三总复习质量检测一理综化学试卷(解析版) 题型:简答题
(14分)2013年初,雾霾天气多次肆虐天津、北京等地区。其中,燃煤和汽车尾气是
造成空气污染的原因之一。
(l)汽车尾气净化的主要原理为:2NO(g) + 2CO(g)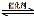 2CO2(g)+ N2(g) △H <0
2CO2(g)+ N2(g) △H <0
①该反应平衡常数表达式____________________________
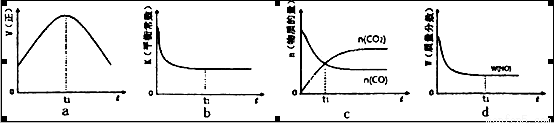
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是________________(填代号)。
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol ①
2NO2(g)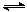 N2O4(g) △H=-56.9 kJ/mol ②
N2O4(g) △H=-56.9 kJ/mol ②
H2O(g)=H2O(l) △H=-44.0 kJ/mol ③
写出CH4催化还原N2O4(g)生成N2和H2O(1)的热化学方程式:_____________________。
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解100mLlmol/L食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变).
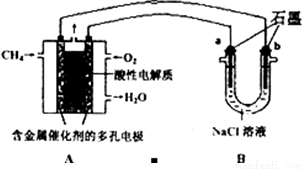
①甲烷燃料电池的负极反应式:______________________________________.
②电解后溶液的pH=____(忽略氯气与氢氧化钠溶液反应)
③阳极产生气体的体积在标准状况下是________L
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市高三第五次月考理综化学试卷(解析版) 题型:实验题
(18分)为验证氧化性Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和 A中加热装置已略,气密性已检验)实验过程如下:
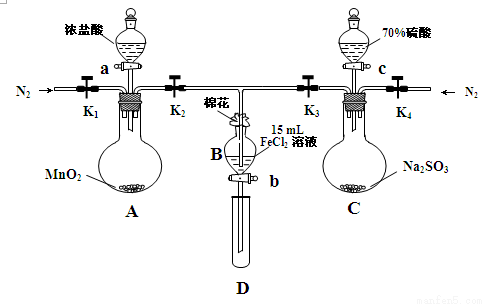
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是_________________________________________________。
(2)棉花中浸润的溶液为______________________。
(3)A中发生反应的化学方程式为 。
(4)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是 。
(5)能说明氧化性Fe3+>SO2的离子方程式是______________________________________。
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是 (填“甲”“乙”“丙”)。
| 过程Ⅳ B溶液中含有的离子 | 过程Ⅵ B溶液中含有的离子 |
甲 | 有Fe3+无Fe2+ | 有SO42- |
乙 | 既有Fe3+又有Fe2+ | 有SO42- |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |
(7)进行实验过程Ⅴ时,B中溶液颜色由黄色逐渐变为红棕色,停止通气,放置一段时间后溶液
颜色变为浅绿色。
查阅资料:Fe2+(aq)+SO32-(aq) FeSO3(s)(墨绿色)
FeSO3(s)(墨绿色)
提出假设:FeCl3与SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色。某同学设计如下实验,证实该假设成立:
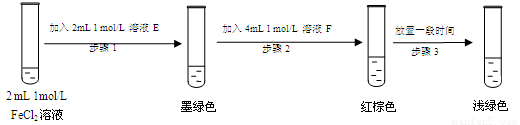
①溶液E和F分别为 、 。
②请用化学平衡原理解释步骤3中红棕色溶液颜色变为浅绿色的原因 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com