
已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH值:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
下列说法或表达中,正确的是
A.少量二氧化碳通入NaClO溶液中:2NaClO + CO2 + H2O Na2CO3 + 2HClO
Na2CO3 + 2HClO
B.过量的 HCN滴入碳酸钠溶液中 HCN + Na2CO3 NaCN+ NaHCO3
NaCN+ NaHCO3
C.结合质子能力由强到弱的顺序为:CO32—>CN—>HCO3—>CH3COO—
D.常温下电离常数:Ki2(H2CO3)>Ki(C6H5OH)>Ki(HCN)
BC
【解析】
试题分析:A、碳酸钠溶液的pH大于次氯酸钠溶液的pH,说明前者水解程度大,因此酸性是次氯酸强于碳酸氢钠,则少量二氧化碳通入NaClO溶液中:NaClO + CO2 + H2O NaHCO3 + HClO,A不正确;B、NaCN溶液的pH介于碳酸氢钠和碳酸钠之间,所以酸性是碳酸>HCN>HCO3—,所以过量的 HCN滴入碳酸钠溶液中 HCN + Na2CO3
NaHCO3 + HClO,A不正确;B、NaCN溶液的pH介于碳酸氢钠和碳酸钠之间,所以酸性是碳酸>HCN>HCO3—,所以过量的 HCN滴入碳酸钠溶液中 HCN + Na2CO3 NaCN+ NaHCO3,B正确;C、酸越弱相应的钠盐越容易水解,则根据溶液的pH值可知酸性强弱顺序为CH3COOH> H2CO3>HClO>HCN>C6H5OH)>HCO3—,所以结合质子能力由强到弱的顺序为:CO32—>CN—>HCO3—>CH3COO—,C正确;D、常温下电离常数:Ki2(H2CO3)>Ki(HCN) >Ki(C6H5OH),D不正确,答案选BC。
NaCN+ NaHCO3,B正确;C、酸越弱相应的钠盐越容易水解,则根据溶液的pH值可知酸性强弱顺序为CH3COOH> H2CO3>HClO>HCN>C6H5OH)>HCO3—,所以结合质子能力由强到弱的顺序为:CO32—>CN—>HCO3—>CH3COO—,C正确;D、常温下电离常数:Ki2(H2CO3)>Ki(HCN) >Ki(C6H5OH),D不正确,答案选BC。
考点:考查盐类水解、弱电解质的电离


科目:高中化学 来源:2013-2014学年天津市高三年级4月考理综化学试卷(解析版) 题型:填空题
已知有机物A分子由C、H、O三种元素组成,其蒸汽密度是相同条件下氢气密度的60倍,0.1molA在足量的氧气中充分燃烧后生成0.8molCO和7.2gH2O,A可以发生银镜反应,其苯环上的一氯代物有3种。
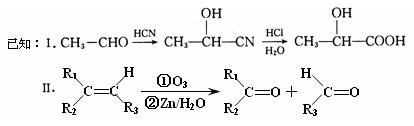
现有如下转化关系: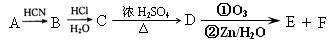 其中D能使溴的四氯化碳溶液褪色,F将继续氧化生成G,G的相对分子质量为90。
其中D能使溴的四氯化碳溶液褪色,F将继续氧化生成G,G的相对分子质量为90。
(1)A中含氧官能团的名称是 ,A的结构简式为 。
(2)C可能具有的化学性质有 (填序号)。
①能与H2发生加成反应
②能在碱性溶液中发生水解反应
③能与甲酸发生酯化反应
④能与Ag(NH3) 2OH溶液发生银镜反应
⑤能与NaOH溶液反应
A.①②③ B.①③⑤ C.①②③⑤ D.②③④⑤
(3) ① 写出C→D的化学反应方程式_______ ;反应类型为_____________________。
② 催化剂条件下,D生成高聚物的化学方程式 ;
③ G与足量NaHCO3溶液反应的化学方程式 。
(4)C的同分异构体有多种,其中符合下列要求的有机物有两种:
①属于酯类化合物 ②遇三氯化铁溶液显紫色
③与新制氢氧化铜悬浊液共热可生成红色沉淀 ④苯环上的一卤代物只有一种
写出其中一种有机物的结构简式 。
(5)聚乳酸(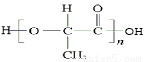 )可以生物降解,请写出以2-丁烯为原料制备聚乳酸的合成路线流程图(无机试剂任选)。
)可以生物降解,请写出以2-丁烯为原料制备聚乳酸的合成路线流程图(无机试剂任选)。
合成路线示例: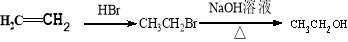
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市房山区高三一模理综化学试卷(解析版) 题型:填空题
氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品及精制的流程:
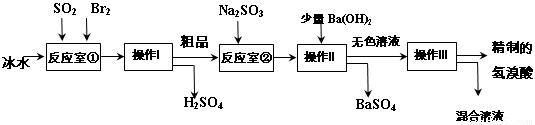
已知:Br2是易挥发、深红棕色的液体;氢溴酸是易挥发、无色液体。
根据上述流程回答下列问题:
(1)反应室①中发生反应的化学方程式为 。
(2)反应室①使用冰水的目的 。
(3)操作I的名称 ,操作Ⅱ用到的玻璃仪器有 。
(4)反应室②中加入Na2SO3的目的是 。
(5)工业生产中制得的氢溴酸带有淡淡的黄色。于是甲乙两同学设计了实验加以探究:
①甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则用于证明该假设所用的试剂为 ,若假设成立可观察到的现象为 。
②乙同学假设工业氢溴酸呈淡黄色是因为 ,其用于证明该假设成立的方法为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市丰台区高三下学期统一练习(一)化学试卷(解析版) 题型:选择题
下列说法正确的是
A.植物油的主要成分是高级脂肪酸
B.银氨溶液可用于检验淀粉是否完全水解
C.溴乙烷与氢氧化钠水溶液反应可制取乙烯
D.丙氨酸(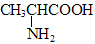 )缩聚产物的结构简式为
)缩聚产物的结构简式为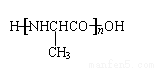
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市闵行区高三二模化学试卷(解析版) 题型:填空题
辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下:

(1)写出步骤“还原”中可能发生反应的离子方程式 、 。
(2)回收S过程中温度控制50℃~60℃之间,不宜过高或过低的原因是 、 。
(3)气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该物质的化学式为 ;向滤液M中加入(或通入)下列 (填字母)物质,得到另一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾 d.盐酸
(4)保温除铁过程中加入CuO的目的是 、 ;
(5)过滤③所得到的滤液,加入硝酸后,经操作X、过滤④得到硝酸铜晶体。
硝酸的作用是 ;
操作X是 、 (填操作名称) 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市闵行区高三二模化学试卷(解析版) 题型:选择题
下列说法中,正确的是
A.用标准盐酸滴定待测氢氧化钠溶液浓度,水洗后的酸式滴定管未经标准液润洗,则滴定结果偏低
B.配制0.1mol/LNaOH溶液时,用潮湿的烧杯称量NaOH固体,对配制结果无影响。
C.测定镀锌铁皮镀层厚度实验,当表面镀层反应完后需将铁皮用水洗,然后用酒精灯高温灼烧冷却后称量,以减少实验误差。
D.测定小苏打中Na2CO3含量的方案:取a(g)样品与足量稀硫酸充分反应,逸出的气体用碱石灰吸收,增重b(g)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市闵行区高三二模化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列叙述中,正确的是
A.12.0gNaHSO4晶体中阳离子和阴离子的总数为0.3 NA
B.14g分子式CnH2n的链烃中含有的碳碳双键的数目一定为NA/n
C.标准状况下,1L液态水中含有的H+数目为10-7NA
D.足量Zn与一定量的浓硫酸反应,产生22.4L气体时,转移的电子数为2 NA
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市徐汇、松江、金山三区高三二模化学试卷(解析版) 题型:选择题
在含有n mol FeI2的溶液中通入Cl2,有x mol Cl2发生反应。下列说法正确的是
A.当x ≤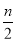 时,反应的离子方程式为:2Fe2++ Cl2 → 2Fe3++ 2Cl-
时,反应的离子方程式为:2Fe2++ Cl2 → 2Fe3++ 2Cl-
B.当x ≥ n时,反应的离子方程式为:2Fe2++ 2I-+ 2Cl2 → 2Fe3++ I2+ 4Cl-
C.当Fe2+和I-同时被氧化时,x与n的关系为x>n
D.当x=n时,反应后氧化产物的物质的量为n mol
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市高一下学期期中考试化学试卷(解析版) 题型:选择题
下面关于化学反应的限度的叙述中,正确的是
A.化学反应的限度都相同
B.可以通过改变温度控制化学反应的限度
C.可以通过延长化学反应的时间改变化学反应的限度
D.当一个化学反应在一定条件下达到限度时,反应即停止
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com