
下列说法正确的是
A.原电池工作,阴离子移向正极
B.铁片表面镀锌,铁片接电源负极
C.用Cu作电极电解H2O,阳极反应为:4OH-- 4e- =2H2O+O2↑
D.向AgCl饱和溶液中加入NaCl固体, c(Cl-)增大,Ksp增大
B
【解析】
试题分析:电子带负电,电极本身不带电,负极流出电子后带正电,因此电解质中阴离子移向负极,正极流入电子后代负电,阳离子移向正极,故A选项错误;电镀时,待镀金属作阴极,阴极与电源负极相连,镀层金属作阳极,阳极与电源正极相连,则铁片做阴极,与电源负极相连,锌片作阳极,与电源正极相连,故B选项正确;电解时,若Cu作电极,则阳极反应式为Cu—2e—=Cu2+,而非电解质中的氢氧根离子放电,故C选项错误;饱和氯化银溶液中存在如下平衡:AgCl(s)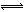 Ag++Cl—,由于氯化钠的溶解度大于氯化银,加入NaCl固体,增大氯离子浓度,平衡向逆反应方向移动,析出氯化银沉淀,氯化银的溶解度降低,但温度不变,溶度积不变,故D选项错误。
Ag++Cl—,由于氯化钠的溶解度大于氯化银,加入NaCl固体,增大氯离子浓度,平衡向逆反应方向移动,析出氯化银沉淀,氯化银的溶解度降低,但温度不变,溶度积不变,故D选项错误。
考点:考查考生原电池和电解原理及应用,考查沉淀溶解平衡的移动及溶度积与平衡移动的关系;设计原电池内电路中离子定向移动方向、电镀时电极类型判断、活性电极上的阳极反应、沉淀溶解平衡的移动与溶度积的关系。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解

| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol CH3OCH3、1mol H2O | 2mol CH3OH | 1mol CH3OH |
| CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 吸收a kJ | 放出b kJ | 放出c kJ |
| 平衡时体积(L) | V1 | V2 | V3 |
| 反应物转化率 | α 1 | α 2 | α 3 |

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 非金属元素氮有多种氧化物,如NO、NO2、N2O4等.
非金属元素氮有多种氧化物,如NO、NO2、N2O4等.| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
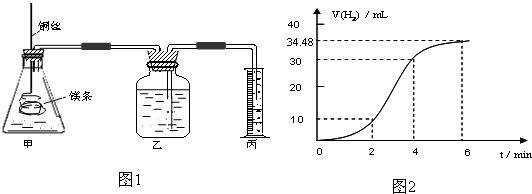
| 实验编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 10%H2O2的体积/mL | 5.0 | 5.0 | V1 | V2 |
| 20%硫酸的体积/mL | 0 | 0.5 | 1.0 | V3 |
| 水的体积/mL | 15 | 14.5 | V4 | 13.5 |
| 所需时间t/s | t1 | t2 | t3 | t4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com