
【题目】A﹣I是中学化学常见的九种物质,A﹣I之间的转化关系如图所示. 
已知化合物A的焰色反应显黄色,C、D、E是气态单质,F、H是气态化合物,两者在通常状况下反应产生大量白烟.请回答下列问题:
(1)写出I的电子式;
(2)写出电解A溶液的离子反应方程式;
(3)以F、空气和水为原料经过一系列的化学反应可以合成酸M,M的浓溶液与铜反应产生红棕色气体,写出M的浓溶液与铜反应的化学方程式 .
(4)G的溶液可使Mg(OH)2悬浊液溶解.若Mg(OH)2饱和溶液中的c(Mg2+)=0.18mol/L,则溶液的pH是 . (已知:Ksp[Mg(OH)2]=1.8×10﹣11mol/L)
【答案】
(1)![]()
(2)2Cl﹣+2H2O ![]() Cl2↑+H2↑+2OH﹣
Cl2↑+H2↑+2OH﹣
(3)Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
(4)9
【解析】解:化合物A的焰色反应显黄色,C、D、E是气态单质,A电解生成C、D,所以A应为NaCl,所以B为NaOH,C、D为Cl2和H2 , C和D反应生成H为HCl,F、H在通常状况下反应产生大量白烟,则F是NH3 , G为NH4Cl,氢氧化钠与氯化铵反应生成I为H2O,E和D反应生成F,所以E为N2 , 以NH3、空气和水为原料经过一系列的化学反应可以合成酸M为HNO3。
(1.)I为H2O,I的电子式为 ![]() ,所以答案是:
,所以答案是: ![]() ;
;
(2.)电解NaCl溶液的离子反应方程式为 2Cl﹣+2H2O ![]() Cl2↑+H2↑+2OH﹣ ,
Cl2↑+H2↑+2OH﹣ ,
所以答案是:2Cl﹣+2H2O ![]() Cl2↑+H2↑+2OH﹣;
Cl2↑+H2↑+2OH﹣;
(3.)M为HNO3 , M的浓溶液与铜反应的化学方程式为Cu+4HNO3 (浓)=Cu(NO3)2+2NO2↑+2H2O,所以答案是:Cu+4HNO3 (浓)=Cu(NO3)2+2NO2↑+2H2O;(4)Mg(OH)2饱和溶液中的c(OH﹣)= ![]() =
= ![]() mol/L=1×10﹣5 mol/L,则溶液的pH是9,所以答案是:9.
mol/L=1×10﹣5 mol/L,则溶液的pH是9,所以答案是:9.


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案科目:高中化学 来源: 题型:
【题目】乙醇是一种重要的化工原料,由乙醇为原料衍生出的部分化工产品如图所示: 
回答下列问题:
(1)A的结构简式为;
(2)B的化学名称是 .
(3)C中含氧官能团的名称是
(4)E是一种常见的塑料,其化学名称是
(5)由乙醇生成F的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,AgCl(s)Ag+(aq)+Cl﹣(aq)在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( ) 
A.加入AgNO3固体,可以使溶液由c点变到d点
B.加入NaCl固体,则AgCl的溶解度减小,Ksp也减小
C.d点有AgCl沉淀生成
D.c点对应的Ksp小于a点对应的Ksp
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,向20mL 0.1molL﹣1的醋酸溶液中不断滴入0.1molL﹣1的NaOH溶液,溶液pH的变化曲线如图,下列关于该过程中溶液中离子浓度大小关系的描述错误的是( ) 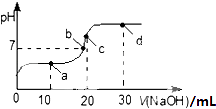
A.a点时:c( CH3COOH)>c( Na+)>c( CH3COO﹣)>c( H+)>c( OH﹣)
B.b点时:c( Na+)=c( CH3COO﹣)>c(H+)=c( OH﹣)
C.c点时:c(OH﹣)=c(CH3COOH)+c(H+)
D.d点时:c(Na+)>c(CH3COO﹣)>c(OH﹣)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示3套实验装置,分别回答下列问题.
(1)装置1为铁的吸氧腐蚀实验.向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为 .
(2)装置2中的石墨是极(填“正”或“负”),该装置发生的总反应的离子方程式为
(3)装置3中甲烧杯盛放100mL 0.2mol/L的NaCl溶液,乙烧杯盛放100mL 0.5mol/L的CuSO4溶液.反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红.
①电源的M端为极;甲烧杯中铁电极的电极反应为 .
②乙烧杯中电解反应的离子方程式为 .
③停止电解,取出Cu电极,洗涤、干燥、称量、电极增重0.64g,甲烧杯中产生的气体标准状况下体积为 mL.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图所示装置制取溴化亚铁.D和d中均盛有液溴,E为外套电炉丝的瓷管,e是两只耐高温的瓷皿,其中共盛有56g细铁粉.实验开始时先将干燥、纯净的CO2气流通入D中,然后将铁粉加热至600℃~700℃,E管中反应开始.E中的反应为:
2Fe+3Br2═2FeBr3 , 2FeBr3 ![]() 2FeBr2+Br2↑,
2FeBr2+Br2↑,
最后将d中液溴滴入100℃~120℃的D中,经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁80g.
请回答:
(1)仪器d的名称 .
(2)导入的CO2不干燥,会在E中发生副反应,其含铁副产物为;若所得产物中含此副产物,用化学方法检验.下列方案合理的是 .
A.取少量产物于试管中加入稀盐酸,再加入KSCN溶液
B.取少量产物于硬质大试管中,通入氢气,排尽空气后加热,用CuSO4检验生成的水蒸气
C.用磁铁吸引,看产物能否被吸引
D.取少量产物于试管中加入蒸馏水,过滤看是否有黑色不溶物
(3)为防止污染空气,实验时应在F处连接盛有NaOH溶液的尾气吸收装置,反应的化学方程式: .
(4)取产品10g配制成250mL溶液,取出25.00mL用酸性KMnO4溶液滴定溶液中的Fe2+ , 用去0.03000mol/L酸性KMnO4溶液25.00mL,则产品的纯度为 .
(5)利用除去杂质后的FeBr2可以验证Cl2、Fe3+、Br2的氧化性强弱.将你设计的实验操作、预计的实验现象和实验结论(氧化性强弱)填写在下列表空格内:
实验操作 | 实验现象 | 氧化性强弱 |
① | 溶液呈血红色 | ② |
③ | ④ | Cl2>Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有一混合物的无色水溶液只可能含有以下离子中的若干种:K+、NH4+、Fe2+、Cl-、Ca2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
第一份加入AgNO3溶液有沉淀产生;
第二份加入足量NaOH溶液加热后,收集到0.08mol气体;
第三份加入足量BaCl2溶液后,得到干燥沉淀12.54g,经足量的盐酸洗涤、干燥后,沉淀质量为4.66g.
综合上述实验,回答下列问题:
(1)不做任何实验就可以肯定原溶液中不存在的离子是__________。
(2)该混合物中一定含有的离子__________;可能含有的离子__________。
(3)K+物质的量: n(K+)_____(具体值或取值范围)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为2L的密闭容器中进行下列反应:C(s)+CO2(g)═2CO(g);△H=+Q kJmol﹣1 . 如图为CO2、CO的物质的量随时间t的变化关系图.下列说法不正确的是( ) 
A.在0﹣1min内CO的物质的量增加了2mol
B.当固焦炭的质量不发生变化时,说明反应已达平衡状态
C.5min时再充入一定量的CO,n(CO)、n(CO2)的变化可分别由c、b曲线表示
D.3min时温度由T1升高到T2 , 重新平衡时K(T2)小于K(T1)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com