
����ij�����£���2 L�ܱ������з������·�Ӧ2NO2(g) ![]() 2NO(g)��O2(g)
2NO(g)��O2(g)
�����ֲ�ͬ�����½��У�����ʵ�����800�棬ʵ�����850�棬NO��O2����ʼŨ�ȶ�Ϊ0��NO2��Ũ��(mol��L-1)��ʱ��(min)�ı仯��ͼ��ʾ����ش��������⣺
��2L�ܱ������ڣ�800��ʱ��Ӧ��2NO2(g)![]() 2NO(g)+O2(g)��ϵ�У�n (NO2)��ʱ��ı仯�����
2NO(g)+O2(g)��ϵ�У�n (NO2)��ʱ��ı仯�����
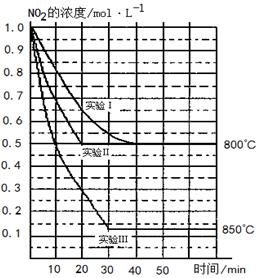
��ʵ��������ķ�Ӧ������
��д���÷�Ӧ��ƽ�ⳣ������ʽ�� K= ��
�÷�Ӧ��________������� �� �š����ȷ�Ӧ��
����ʵ����д�ƽ��������ܱ�������ͨ��2 mol�����ʵ���֮��Ϊ1��1��ɵ�NO2��O2������壨�����¶Ȳ��䣩����ƽ�⽫ �ƶ���
�����������ڢ������õ�ƽ��������ͨ��������NaOH��Һ�У�ʹ���屻��ȫ���ա�
���ɵIJ��P�����ʵ���Ϊ ��
��NO2��NO����Ҫ�Ĵ�����Ⱦ���������������NH3��һ����������֮��Ӧ������ת
��Ϊ���IJ������ѭ�������ʣ��÷�Ӧ�Ļ�ѧ����ʽΪ ��
����дһ����

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com