
| A. | 1 mol A 与足量的酸反应生成的H2比1 mol B生成的H2多 | |
| B. | A原子电子层数比B原子的电子层数多 | |
| C. | 常温时,A能从水中置换出氢,而B不能 | |
| D. | A原子的最外层电子数比B原子的最外层电子数少 |
分析 比较金属的活泼性可根据金属之间的置换反应及金属与酸反应置换氢气的难易程度判断,金属与水反应的难易程度,原电池的正负极判断等方面判断,不能从电子层的多少、最外层电子数的多少以及生成氢气的多少的角度判断.
解答 解:A、产生氢气的多少取决于金属失去电子数的多少,金属的活泼性与得失电子难易有关,与得失电子数目多少无关,故A错误;
B、如金属不位于同一主族,则不能根据电子层数的多少来判断金属的活泼性强弱,故B错误;
C、金属的活泼性越强,越易与水反应,常温时,A能从水中置换出氢,而B不能,说明金属的活泼性A比B活泼,故C正确;
D、最外层电子数少的金属金属性不一定比最外层电子数多的金属性强,如锂比钙弱,故D错误;
故选C.
点评 本题考查金属的活泼性的比较,题目难度不大,比较金属活泼性的角度很多,注意基础知识的积累.


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气的电子式:Cl:Cl | |
| B. | 硫酸铵的电离方程式:Na2SO4═Na++SO42- | |
| C. | 钠原子的结构示意图: | |
| D. | NH3分子的比例模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核外的电子像云雾一样笼罩在原子核周围,故称电子云 | |
| B. | s轨道呈球形,处在该轨道上的电子只能在球壳内运动 | |
| C. | p轨道呈哑铃形,在空间有两个伸展方向 | |
| D. | 与s电子原子轨道相同,p电子原子轨道的平均半径随能层的增大而增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
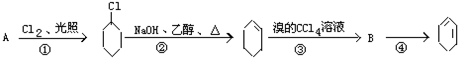
 ,B的结构简式是
,B的结构简式是 .
. +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +2NaBr+2H2O.
+2NaBr+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com