
A��һ�ֳ�����������ͬ����������������ܶ�Ϊ13��D����С�մ�Ӧ�������壬����֮���������ͼ��ʾ��ת����ϵ����Ӧ������������ȥ����

��ش�
(1)D�к��й����ŵ�������________________��
(2)��Ӧ�ݷ����������Ǽ��Ⱥʹ������仯ѧ����ʽΪ________________��
(3)������ȩ�����������ſ���ѡ�õ��Լ���________________��
(4)����˵����ȷ����________________��
a��������Ӧ�����ڼӳɷ�Ӧ��ֻ�Тٺ͢� b����ȥC�к���D�ɼ���ʯ������
c����ҵ�ϻ�ô���B��ͨ��ʯ���ѻ����� d�������ʵ���B��C��ȫȼ�պ�������ͬ

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��������ʡ���н���������2017������߿�ģ���Ծ���һ�����ۻ�ѧ�Ծ� ���ͣ�ѡ����
��֪�л���A. B֮�����ת����ϵ��A(C6H12O2) +H2O B+HCOOH������ƽ������ϸ÷�Ӧ�������л���B�У����������칹��
B+HCOOH������ƽ������ϸ÷�Ӧ�������л���B�У����������칹��
A. 6�� B. 7�� C. 8�� D. 9��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�캣��ʡ�������ߴ��¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
���������У�������ֱ�Ӽ��ȵ��ǣ�
����Ͳ ������ƿ ��������ƿ ���Թ� �������� ���ձ� ������ ����ƿ
A. �ۢܢ� B. �ܢݢ� C. �ڢܢ� D. �ܢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017������ʡ������ѧ�ڵڶ���ģ����ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪H2(g)+Br2(l)=2HBr(g);��H=��72KJ/mol������1molBr2(l)��Ҫ���յ�����Ϊ30KJ������������������±���
H2(g) | Br2(g) | HBr(g) | |
1mol�����л�ѧ������ ʱ��Ҫ���յ�����/kJ | 436 | a | 369 |
�����aΪ
A. 404 B. 260 C. 230 D. 200
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017���㽭ʡ����3��ѡ����ѧ�Ծ��������棩 ���ͣ������
�������-��(III)���K3 [Fe(C2O4)3]��3H2O (Mr=491)Ϊ��ɫ���壬������ˮ���������Ҵ����л��ܼ���110���¿�ʧȥ�ᾧˮ��230��ʱ���ֽ⣬���Ʊ������ͻ�������������Ҫԭ�ϡ������������Ϊԭ���Ʊ����������(III)��ؾ��������������ʾ��

��ش��������⣺
(1)ʵ������Ҳ����Fe3+�δ���������������Ʊ��þ��壬�����ü�Һ����Fe3+������ͬŨ�ȵ�NaOH��Һ��ˮͨ����ͬ������������ѡ��______�ܻ�ÿ����ϴ��Fe(OH)3��
(2)���������в���ˮԡ���ȣ���������¶�Ϊ40�棬������_______��������Ӧ�Ļ�ѧ����ʽΪ_______��������ȫ���轫������Һ��У�Ŀ����__________________��
(3)���ڹ���X������˵���в���ȷ����________________��
A.�ɲ�����ȴ������Һ�м����Ҵ��ķ�����ʹ��������
B��Ϊ�˿��ٵõ��ϸ���Ĺ��壬���Բ��ó��˵ķ���
C��ϴ�Ӿ���ʱ������������ˮϴ�������Ҵ�ϴ
D�����ü��Ⱥ�ɵķ����õ��ϸ���ľ���
��4��Ϊ�˷�����Ʒ���ȣ��������²�����
ȷ��ȡ��Ʒ0.9350g�����Ƴ�250mL��Һ��ÿ����ȡ25.00mL������ƿ�У���������ϡH2SO4�ữ����C2O42-ת��ΪH2C2O4����0.0100mol/LKMnO4��Һ�ζ����յ㣬������_______��ƽ�вⶨ���Σ�����KMnO4������ֱ�Ϊ20.02mL��19.98mL��20.00mL�������ôֲ�Ʒ�Ĵ���Ϊ_________________��(��֪��5 H2C2O4+2 MnO4-+6H+=10CO2��+2Mn2++8H2O)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017���㽭ʡ����3��ѡ����ѧ�Ծ��������棩 ���ͣ�ѡ����
�ֽ�2molA��1molB����2L�ܱ������з�����Ӧ��2A(g)+B(g)  2C(g)���ֱ���Tl��T2ʱ���������C�����ʵ�����ʱ��仯��ͼ��ʾ������˵����ȷ����
2C(g)���ֱ���Tl��T2ʱ���������C�����ʵ�����ʱ��仯��ͼ��ʾ������˵����ȷ����
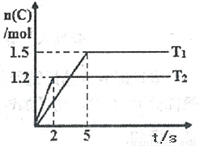
A. T1<T2
B. �÷�Ӧ���¶�ΪT1ʱ�ﵽƽ��ʱ��������A��C�����ʵ���Ũ�����
C. �¶�ΪT2ʱ��2s��B��ƽ������Ϊ0.3mol��L-1��s-l
D. �¶�ΪT1ʱ����ƽ��ʱ��Ӧ��A��ת����Ϊ60%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017���㽭ʡ����3��ѡ����ѧ�Ծ��������棩 ���ͣ�ѡ����
������Ԫ��X��Y��Z��M��ԭ��������������ԭ��X��L���������K���2����Y2+���Ӳ�ṹ������ͬ��Zԭ�ӵ�������Ϊż����������M����Ϊ����ɫ���壬�����й�˵����ȷ����
A. X��Y��Z��M��ԭ�Ӱ뾶���μ�С
B. Y��M��ɻ�������۵����X��M��ɵĻ�����
C. X��Z��M����ͼ���̬�⻯������ȶ���������ǿ
D. X�ĵ�����Y��Z�������������ܷ����û���Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�������ʡ��һ��ѧ�ڿ�ѧ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��Na2CO3��NaAlO2�Ļ����Һ����μ���150mL 1mol•L-1��HCl��Һ�������Һ�е�ij�����������ʵ����ı仯��ͼ��ʾ��������˵������ȷ���ǣ� ��
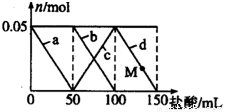
A. a���߱�ʾ�����ӷ���ʽΪ��AlO2-+H++H2O=Al��OH��3
B. b��c���߱�ʾ�����ӷ�Ӧ����ͬ��
C. M��ʱAl��OH��3������С��3.9g
D. ԭ�����Һ�е�CO32-��AlO2-�����ʵ���֮��Ϊ2��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ���½����ܵ����ڶ���ѧ�߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��ˮϡ��0.1mol/L��ˮʱ����Һ������ˮ�������Ӷ���С���� ( )
A. c(OH��)/c(NH3��H2O) B. c(NH3��H2O)/ c(OH��)
C. C. c(OH��)�� c(H�� ) D. n(NH4+)
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com