
有甲、乙、丙、丁四种金属,把甲、丙浸入稀硫酸中,用导线连接时丙为负极;把乙、丁分别浸入稀硫酸中,丁产生气泡的速率更大;把甲、乙用导线连接浸入稀硫酸中,甲上有气泡冒出;把丙浸入丁的硝酸盐溶液中,丙的表面有丁析出.这四种金属的活动性由强到弱的顺序是.
考点: 常见金属的活动性顺序及其应用.
专题: 几种重要的金属及其化合物.
分析: 一般来说,作原电池负极的金属活动性较强;金属与酸发生反应的条件:在金属的活动性顺序表中排在H前面的金属能与酸发生反应,产生氢气,不同金属与相同的酸反应,生成氢气速率越大则金属的活动性越强,H后面的金属不能与酸反应;金属与盐溶液发生反应的条件:活泼金属能置换出不活泼金属,在金属的活动性顺序表中排在前面的金属能把它后面的金属从其盐溶液中置换出来,据此判断金属的活动性强弱.
解答: 解:一般来说,作原电池负极的金属活动性较强,把甲、丙分别浸入稀硫酸中,用导线连接时丙为负极,则活泼性丙>甲;
不同金属与相同的酸反应,生成氢气速率越大则金属的活动性越强,乙、丁分别浸入稀硫酸中,丁产生气泡的速率更大,则活泼性乙<丁;
作原电池负极的金属活动性较强,气泡在正极出现,把甲、乙用导线连接浸入稀硫酸中,甲上有气泡冒出,甲是正极,所以活泼性乙>甲,
活泼金属能置换出不活泼金属,把丙浸入丁的硝酸盐溶液中,丙的表面有丁析出,说明活泼性是丙>丁,
所以金属的活泼性是:丙>丁>乙>甲,
故答案为:丙>丁>乙>甲;
点评: 本题考查了金属的活动性的判断,根据金属与酸发生反应的条件、以及金属与盐溶液发生反应的条件,原电池的正负极,可判断金属的活动性强弱,题目难度不大.


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
膦(PH3)又称磷化氢,在常温下是一种无色有大蒜臭味的有毒气体,它的分
子构型是三角锥形。以下关于PH3的叙述正确的是
A.PH3分子中有未成键的孤对电子
B.P原子形成sp2杂化轨道
C.P-H键间的夹角为109°28′
D.PH3分子的P-H键是非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器里,A与B反应生成C,其反应速率分别用vA、vB、vC表示,已知2vB=3vA、3vC=2vB,则此反应可表示为()
A. 2A+3B=2C B. A+3B=2C C. 3A+B=2C D. A+B=C
查看答案和解析>>
科目:高中化学 来源: 题型:
下列水解的离子方程式正确的是()
A. HS﹣+H2O⇌S2++H2O+ B. Fe3++3H2O⇌Fe(OH)3↓+3H+
C. CO32﹣+2H2O⇌H2CO3+2OH﹣ D. NH4++H2O⇌NH3•H2O+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与生活密切相关,下列说法不正确的是()
A. 人体内不含消化纤维素的消化酶,因此食物纤维对人体无用
B. 碳酸氢钠可用于治疗胃酸过多和焙制糕点
C. 油脂从化学成分上讲属于酯类化合物,是人类的主要营养物质之一
D. 维生素有20多种,它们多数在人体内不能合成,需要从食物中摄取
查看答案和解析>>
科目:高中化学 来源: 题型:
某配位化合物的水溶液为深蓝色,由原子序数依次增大的A、B、C、D、E五种元素组成,其原子个数比为l4:4:5:1:1.其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n﹣1)d n+6nsl,回答下列问题.
(1)元素D在周期表中的位置是 .
(2)该配位化合物的化学式为 .
(3)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,两种化合物可任意比互溶,解释其主要原因为 .
(4)A元素与B元素可形成分子式为A2B2的某化合物,该化合物的分子具有平面结构,则其结构式为 .
(5)已知E的晶胞结构如下图所示,则E的配位数 ;EDC4常作电镀液,其中DC42﹣的空间构型是 ,其中D原子的杂化轨道类型是 .
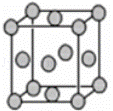
查看答案和解析>>
科目:高中化学 来源: 题型:
根据碘与氢气反应的热化学方程式,下列判断正确的是 ( )
① I2(g)+ H2(g)  2HI(g) △H=-9.48 kJ/mol
2HI(g) △H=-9.48 kJ/mol
② I2(s)+ H2(g)  2HI(g) △H=+26.48 kJ/mol
2HI(g) △H=+26.48 kJ/mol
A.254g I2(g)中通入2g H2(g),反应放热9.48 kJ
B.当反应②吸收52.96kJ热量时转移2mole一
C.反应②的反应物总能量比反应①的反应物总能量低
D.1 mol固态碘与1 mol气态碘所含能量相差17.00 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子在溶液中可以大量共存的一组是()
A. H+、Na+、OH﹣、NO3﹣ B. Na+、Fe3+、NO3﹣、Cl﹣
C. NH4+、H+、HCO3﹣、SO42﹣ D. Ag+、Ca2+、SO42﹣、CO32﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com