
分析 (1)两个容器中反应物起始量相同,体积相同,甲容器在温度为T1的条件下反应,达到平衡时NH3的物质的量为0.8mol,乙容器在温度为T2的条件下反应,达到平衡时N2的物质的量为0.1mol,消耗氮气物质的量=0.6mol-0.1mol=0.5mol,生成氨气物质的量1mol,说明乙反应正反应进行程度大,反应是放热反应,所以温度越低,反应正向进行程度大,结合三段式计算平衡浓度,平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
(2)在燃料电池中,燃料做负极,则通入氨气的电极是负极,碱性条件下氨气失电子生成氮气,结合电荷守恒和原子守恒配平书写电极反应;
(3)依据热化学方程式和盖斯定律计算目标热化学方程式得到焓变,标准状况下4.48LCH4物质的量=$\frac{4.48L}{22.4L/mol}$=0.2mol,结合热化学方程式定量关系计算;
(4)氧化还原反应中元素化合价升高的物质做还原剂被氧化,分析化学方程式计算电子转移总数得到反应生成硫单质物质的量,硫元素守恒得到硫酸物质的量,浓硫酸和足量铜反应随反应进行,浓度减小,变为稀硫酸后不能与铜继续发生反应;
(5)pH=1的醋酸中醋酸的浓度大于0.1mol/L,则通入0.1mol氨气反应后,醋酸有剩余,醋酸电离的氢离子能抑制铵根离子的电离,氨气与硫酸和盐酸恰好反应;
醋酸铵溶液呈中性,则一水合氨和醋酸的电离常数相同,常温下CH3COOH的Ka=1×10-5 mol•L-1,所以NH3•H2O的电离常数为1×10-5 mol•L-1,Ka=$\frac{[N{{H}_{4}}^{+}][{H}^{+}]}{[N{H}_{3}•{H}_{2}O]}$,Kh=$\frac{Kw}{Ka}$=1×10-9,据此计算.
解答 解:(1)向甲、乙两个均为2L的密闭容器中,分别充入0.6molN2和1.6molH2,发生反应:N2(g)+3H2(g)?2NH3(g)△H<0,甲容器在温度为T1的条件下反应,达到平衡时NH3的物质的量为0.8mol,乙容器在温度为T2的条件下反应,达到平衡时N2的物质的量为0.1mol,依据化学方程式计算得到消耗氮气物质的量=0.6mol-0.1mol=0.5mol,生成氨气物质的量1mol,说明乙反应正反应进行程度大,反应是放热反应,降低温度,平衡正向进行,则乙容器中反应的温度低于甲容器中的温度,T1<T2,乙中温度低反应进行程度大,平衡常数大,
依据化学平衡三段式列式计算甲容器中物质的平衡浓度,起始浓度c(N2)=$\frac{0.6mol}{2L}$=0.3mol/L,c(H2)=$\frac{1.6mol}{2L}$=0.8mol/L,平衡时c(NH3)=$\frac{0.8mol}{2L}$=0.4mol/L
N2(g)+3H2(g)?2NH3(g)
起始量(mol/L) 0.3 0.8 0
变化量(mol/L) 0.2 0.6 0.4
平衡量(mol/L) 0.1 0.2 0.4
K=$\frac{0.{4}^{2}}{0.1×0.{2}^{3}}$=200,
故答案为:<,200;
(2)在燃料电池中,燃料做负极,则通入氨气的电极是负极,碱性条件下,该电极发生反应的电极反应式为2NH3-6e-+6OH-=N2+6H2O.
故答案为:2NH3-6e-+6OH-=N2+6H2O;
(3))①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1
②CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H3=-867kJ•mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2
依据盖斯定律计算,②×2-①得到CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ•mol-1,
标准状况下4.48LCH4物质的量=$\frac{4.48L}{22.4L/mol}$=0.2mol,热化学方程式计算得到0.2mol甲烷反应放热=$\frac{1160KJ×0.2mol}{1mol}$=232KJ,
故答案为:232;
(4)HNO3和As2S3能发生反应:As2S3+10HNO3═2H3AsO4+3S+10NO2↑+2H2O,反应中As元素化合价+3价变化为+5价,化合价升高被氧化,S元素化合价-2价变化为0价,元素化合价升高被氧化,所以被氧化的元素为As、S,电子转移总数依据发生氧化还原反应的硝酸计算得到,生成10molNO2,电子转移10×[(+5)-(+4)}=10mol,生成S为3mol,若该反应中转移的电子的物质的量为5mol时,生成S为1.5mol,将生成的S全部转化为浓H2SO4物质的量为1.5mol,Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,若硫酸全部反应消耗铜0.75mol,但浓硫酸和足量铜反应随反应进行,浓度减小,变为稀硫酸后不能与铜继续发生反应,所以消耗铜物质的量小于0.75mol,
故答案为:As,S;a;
(5)pH=1的醋酸中醋酸的浓度大于0.1mol/L,则通入0.1mol氨气反应后,醋酸有剩余,醋酸电离的氢离子能抑制铵根离子的电离,铵根离子浓度较大,氨气与硫酸和盐酸恰好反应,所以溶液中铵根离子浓度:c1=c2<c3,
醋酸铵溶液呈中性,则一水合氨和醋酸的电离常数相同,常温下CH3COOH的Ka=1×10-5 mol•L-1,所以NH3•H2O的电离常数为1×10-5 mol•L-1,
Ka=$\frac{[N{{H}_{4}}^{+}][{H}^{+}]}{[N{H}_{3}•{H}_{2}O]}$=1×10-5,Kh=$\frac{Kw}{Ka}$=1×10-9,
设c(H+)为xmol/L,
则Kh=$\frac{{x}^{2}}{0.1}$=1×10-9,解得x=1×10-5mol/L,所以pH=5;
故答案为:c1=c2<c3,5.
点评 本题考查较综合,涉及平衡常数计算、反应速率计算、原电池电极反应的书写、弱电解质的电离等知识点,这些都是高考高频点,侧重考查学生分析、计算及知识运用能力,中等难度,答题时注意化学原理知识的灵活运用.


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:解答题
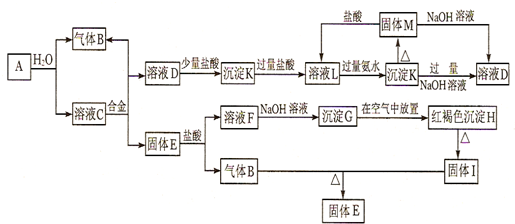
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①③ | B. | 只有①② | C. | 只有②③ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将5 mL 0.02 mol/L的H2SO4溶液与5 mL 0.02 mol/L NaOH溶液充分混合,若混合后溶液的体积为10 mL,则混合液的pH=2 | |
| B. | 某物质的溶液中由水电离的c(H+)=1×10-amol/L,若a>7,则pH一定为14-a | |
| C. | pH相等的①CH3COONa ②C6H5ONa ③NaHCO3溶液中,c(Na+)大小关系:①>③>② | |
| D. | CH3COONa溶液中加入少量KNO3固体后的碱性溶液一定有:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
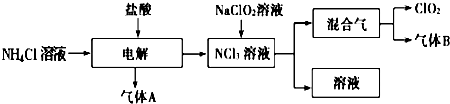
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷 | B. | 乙烯 | C. | 乙炔 | D. | 酒精 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类、油脂、蛋白质都是由C、H、O三种元素组成的 | |
| B. | 糖类、油脂、蛋白质都是高分子化合物 | |
| C. | 生物油和矿物油均可发生水解反应 | |
| D. | 煤的干馏、煤的气化,液化、石油裂化、乙烯聚合都属于化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
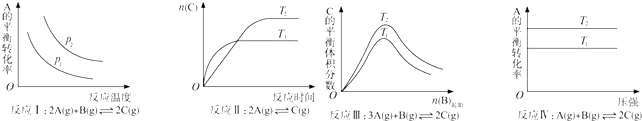
| A. | 反应Ⅰ:△H>0,P2>P1 | B. | 反应Ⅱ:△H<0,T1>T2 | ||
| C. | 反应Ⅲ:△H>0,T2<T1;或△H<0,T2>T1 | D. | 反应Ⅳ:△H<0,T2>T1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com