
科目: 来源:2017届北京市海淀区高三上学期期中化学试卷(解析版) 题型:选择题
X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。

下列说法不正确的是
A. 简单阳离子半径:X< R
B. 最高价含氧酸的酸性:Z < Y
C. M的氢化物常温常压下为气体
D. X与Y可以形成正四面体结构的分子
查看答案和解析>>
科目: 来源:2017届北京市海淀区高三上学期期中化学试卷(解析版) 题型:选择题
某同学进行下列实验:
装置 | 操作 | 现象 |
| 将盛有浓硝酸的烧杯A放入盛有淀粉KI溶液的烧杯C中,然后将铜片放入烧杯A后,立即用烧杯B罩住 | 烧杯A液体上方立即出现大量红棕色气体;一段时间后,红棕色气体消失,烧杯A和C中的液体都变成蓝色 |
下列说法合理的是
A.烧杯A中发生反应:3Cu+8HNO3===3Cu(NO3)2+2NO↑+4H2O
B.红棕色气体消失只与NO2和烧杯C中的KI发生反应有关
C.烧杯C中溶液变蓝只与NO2和C中溶液发生反应有关
D.若将铜片换成铁片,则C中的液体也可能变蓝
查看答案和解析>>
科目: 来源:2017届北京市海淀区高三上学期期中化学试卷(解析版) 题型:选择题
下列实验方案中不能达到相应实验目的的是
A | B | C | D | |
方案 |
|
|
已知溶解度(20℃) NaHCO3:9.6 g Na2CO3:21.8 g |
将NO2球浸泡在冷水和热水中 |
目的 | 探究浓度对化学 反应速率的影响 | 制备氨气 | 室温下比较NaHCO3和Na2CO3的溶解度 | 探究温度对化学平衡的影响 |
查看答案和解析>>
科目: 来源:2017届北京市海淀区高三上学期期中化学试卷(解析版) 题型:选择题
合成氨及其相关工业中,部分物质间的转化关系如下:
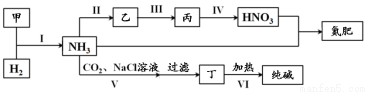
下列说法不正确的是
A.甲、乙、丙三种物质中都含有氮元素
B.反应II、III和Ⅳ的氧化剂相同
C.VI的产物可在上述流程中被再次利用
D.V中发生反应:NH3+CO2+H2O+NaCl===NaHCO3↓+NH4Cl
查看答案和解析>>
科目: 来源:2017届北京市海淀区高三上学期期中化学试卷(解析版) 题型:选择题
在100℃时,将0.40 mol NO2气体充入2 L的密闭容器中,发生如下反应:2NO2(g)  N2O4(g) ∆H < 0。监测反应获得如下数据:
N2O4(g) ∆H < 0。监测反应获得如下数据:
时间/s | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
下列说法正确的是
A.0~20 s内,v(NO2) = 0.005 mol·L-1.s-1
B.59 s时,c(NO2)一定大于0.12 mol·L-1
C.若仅将起始时充入NO2的量增至0.80 mol,则该反应的平衡常数K > 25/9
D.若上述反应在120℃时进行,则反应至80 s时,n(N2O4) < 0.08 mol
查看答案和解析>>
科目: 来源:2017届北京市海淀区高三上学期期中化学试卷(解析版) 题型:选择题
已知: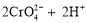

 。25℃时,调节初始浓度为1.0 mol•L-1 的Na2CrO4溶液的pH,测定平衡时溶液中c(
。25℃时,调节初始浓度为1.0 mol•L-1 的Na2CrO4溶液的pH,测定平衡时溶液中c( )和c(H+),获得如右图所示的曲线。下列说法不正确的是
)和c(H+),获得如右图所示的曲线。下列说法不正确的是
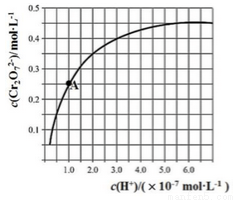
A.平衡时,pH越小,c( )越大
)越大
B.A点CrO 的平衡转化率为50%
的平衡转化率为50%
C.A点CrO 转化为
转化为 反应的平衡常数K=1014
反应的平衡常数K=1014
D.平衡时,若溶液中c( )=c(
)=c( ),则c(H+) > 2.0×10-7 mol·L-1
),则c(H+) > 2.0×10-7 mol·L-1
查看答案和解析>>
科目: 来源:2017届北京市海淀区高三上学期期中化学试卷(解析版) 题型:推断题
W、X、Y、Z是原子序数依次增大的四种短周期元素。W的气态氢化物能使紫色石蕊溶液变蓝,W和X两种元素的最高价氧化物的水化物均能与Y的氢氧化物发生反应,W、X、Y、Z的最外层电子数之和为16。
(1)W单质的电子式是 。
(2)请用化学用语解释W的气态氢化物能使紫色石蕊溶液变蓝的原因: 。
(3)已知As元素的原子序数为33,与W在同一主族,As在元素周期表中的位置是 。
(4)W的最高价氧化物的水化物与Y的氢氧化物发生反应的离子方程式是 。
(5)X与Z的单质之间发生反应的化学方程式是 。
(6)已知Q与Z是位于相邻周期的同主族元素。某温度下,两种元素的气态单质与H2发生化合反应生成气态氢化物的平衡常数分别为KQ= 5.6×107,KZ = 9.7×1012。Q的元素符号是 ,理由是 。
查看答案和解析>>
科目: 来源:2017届北京市海淀区高三上学期期中化学试卷(解析版) 题型:实验题
在化学研究中,往往可以通过观察现象认识物质变化的情况。请分析以下一组有现象变化的化学反应。

(1)用离子方程式解释现象I中出现胶状沉淀的原因: 。
(2)II中加碱时出现的现象是 ,此现象说明溶液中发生反应的离子方程式是 。
(3)III中加碱时出现的现象是 。
(4)用离子方程式解释IV中加碱时出现的现象: 。
(5)滴加试剂顺序的变化,会影响溶液中的现象和发生的反应,请继续分析以下实验。
实验 | 试剂及操作 | 现象 | |
试管 | 滴管 | ||
1.0 mL | 0.1 mol·L?1 Fe(NO3)2溶液 | 先滴加1.5 mL 1.0 mol·L?1 H2SO4溶液; 再滴加1.0 mL 0.5 mol·L?1 NaOH溶液 | V.加酸时溶液无明显现象;加碱后溶液依然没有明显变化 |
①探究加酸时Fe(NO3)2溶液中是否发生了反应:向1.0 mL 0.1 mol·L?1 Fe(NO3)2溶液中 ,溶液立即变红,说明溶液中含Fe3+,证明加酸时溶液中发生了反应。
② 推测溶液中产生Fe3+的可能原因有两种:
a.酸性条件下,0.1 mol·L?1 Fe(NO3)2溶液中的Fe2+被NO3-氧化;
b. (用离子方程式表示)。
查看答案和解析>>
科目: 来源:2017届北京市海淀区高三上学期期中化学试卷(解析版) 题型:填空题
利用硫铁矿(主要成分FeS2)生产硫酸和绿矾(FeSO4·7H2O)的工业流程示意图如下:
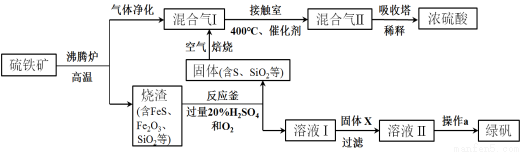
(1)沸腾炉中,硫铁矿进行粉碎处理的目的是 。
(2)接触室中,发生的主要反应是SO2与O2的反应,其化学方程式是 。
(3)反应釜中,烧渣经过反应转化为溶液I和固体。
① 烧渣中的FeS在反应中做 剂(填“氧化”或“还原”)。
② 溶液I中所含溶质的化学式是 。
(4)操作a的主要步骤是:加热浓缩、 、过滤洗涤。
(5)流程中,固体X可以选择硫铁矿(FeS2)或 ;当固体X为硫铁矿(FeS2)时,将溶液I与固体X发生反应的离子方程式补充完整:
FeS2+ +
+ ===
=== Fe2++
Fe2++ SO42-+
SO42-+
查看答案和解析>>
科目: 来源:2017届北京市海淀区高三上学期期中化学试卷(解析版) 题型:填空题
煤制天然气工艺是煤高效洁净利用的新途径之一,其工艺流程简图如下:

(1)反应I:C(s)+H2O(g) CO(g)+H2(g)ΔH=+135kJ·mol-1,通入的氧气会与部分碳发生燃烧反应。请利用能量转化及平衡移动原理说明通入氧气的作用: 。
CO(g)+H2(g)ΔH=+135kJ·mol-1,通入的氧气会与部分碳发生燃烧反应。请利用能量转化及平衡移动原理说明通入氧气的作用: 。
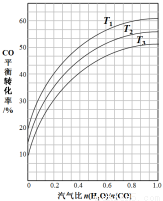
(2)反应II:CO(g)+H2O(g) CO2(g)+H2(g)ΔH=?41kJ·mol-1。下图表示不同温度条件下,煤气化反应I发生后的汽气比(水蒸气与原料气中CO物质的量之比)与CO平衡转化率的变化关系。
CO2(g)+H2(g)ΔH=?41kJ·mol-1。下图表示不同温度条件下,煤气化反应I发生后的汽气比(水蒸气与原料气中CO物质的量之比)与CO平衡转化率的变化关系。
①判断T1、T2和T3的大小关系: 。
②若煤气化反应I发生后的汽气比为0.8,经煤气化反应I和水气变换反应II后,得到CO与H2的物质的量之比为1:3,则反应II应选择的温度是 (填“T1”“T2”或“T3”)。
(3)①甲烷化反应IV发生之前需要进行脱酸反应III。煤经反应I和II后的气体中含有两种酸性气体,分别是H2S和 。
②工业上常用热碳酸钾法脱除H2S气体得到两种酸式盐,该反应的化学方程式是 。
(4)已知:CO(g)+H2O(g) CO2(g)+H2(g) ∆H1=?41kJ·mol?1
CO2(g)+H2(g) ∆H1=?41kJ·mol?1
2H2(g)+O2(g) 2H2O(g) ∆H2=?484kJ·mol?1
2H2O(g) ∆H2=?484kJ·mol?1
CH4(g)+2O2(g) CO2(g)+2H2O(g) ∆H3=?802kJ·mol?1
CO2(g)+2H2O(g) ∆H3=?802kJ·mol?1
反应IV:CO(g)+3H2(g) CH4(g)+H2O(g) ∆H= 。
CH4(g)+H2O(g) ∆H= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com