
科目: 来源:2017届江苏省盐城市高三上学期期中化学试卷(解析版) 题型:选择题
最近中国科学院上海高等研究院在合成气直接制烯烃研究获重大突破。已知:
反应①:C(s)+1/2O2(g)=CO(g) △H1
反应②:C(s)+H2O(g)=CO(g)+H2(g) △H2
反应③:CO(g)+2H2(g)=CH3OH(g) △H3=-90.1kJ·mol-1
反应④:2CH3OH(g)=CH3OCH3(g)+H2O(g) △H4=-134.0kJ·mol-1
反应⑤:3CH3OH(g)=CH3CH=CH2(g)+3H2O(g) △H5=-31.0kJ·mol-1
下列说法正确的是
A.△H1-△H2<0
B.反应②为放热反应
C.3CH3OCH3(g)=2CH3CH=CH2(g)+3H2O(g) △H=-103.0kJ·mol-1
D.3CO(g)+6H2(g)=CH3CH=CH2(g)+3H2O(g) △H=-301.3kJ·mol-1
查看答案和解析>>
科目: 来源:2017届江苏省盐城市高三上学期期中化学试卷(解析版) 题型:实验题
碘化钡(BaI2·2H2O)是一种白色粉末,常用于制取其他含碘化合物。一种制备流程如下:
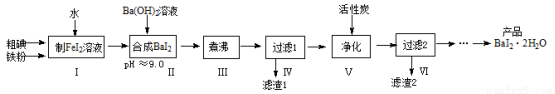
(1)步骤Ⅰ制FeI2溶液时,提高反应速率的可行措施有 (填序号)。
a.铁粉和碘粉用球磨机磨成细粉
b.增大n(铁粉)∶n(碘)的配料比
c.适当升高反应温度和搅拌速度
d.向反应器中加水至I2全部溶解
(2)步骤Ⅱ发生反应的化学方程式为 ;用pH试纸测定溶液pH的方法是 。
(3)步骤Ⅲ小心“煮沸”约20分钟,可使Fe(OH)2颗粒长大,其目的是 ;步骤V加入活性炭的目的是 。
(4)从过滤2所得滤液中获得BaI2·2H2O(溶解度曲线如右图所示)的方法是 。
查看答案和解析>>
科目: 来源:2017届江苏省盐城市高三上学期期中化学试卷(解析版) 题型:推断题
盐酸赛庚啶是一类抗凝血、抗过敏类新药,其关键中间体H的合成路线如下:

(1)D中含氧官能团名称为 和 。
(2)D→E的反应类型为 。
(3)C还原可得到D,C的分子式为C15H12O3,写出C的结构简式 。
(4)写出同时满足下列条件的E的一种同分异构体的结构简式 。
①含有两个苯环且能发生银镜反应
②分子中只有4种不同化学环境的氢
(5)请以 为原料制备
为原料制备 ,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目: 来源:2017届江苏省盐城市高三上学期期中化学试卷(解析版) 题型:实验题
PbO2及2PbCO3·Pb(OH)2(碱式碳酸铅)均是生产铅酸蓄电池正极的原料。
(1)PbO2可由NaClO氧化Pb(NO3)2溶液得到。
①Pb(NO3)2被氧化为PbO2的离子方程式为 。
②Pb(NO3)2溶液中通入H2S发生Pb2+(aq)+H2S(aq) PbS(s)+2H+(aq),直至平衡,该反应的平衡常数为K= [已知:Ksp(PbS)= 3.55×10-28;H2S电离常数Ka1=1.3×10-7,Ka2=7.1×10-15 ]。
PbS(s)+2H+(aq),直至平衡,该反应的平衡常数为K= [已知:Ksp(PbS)= 3.55×10-28;H2S电离常数Ka1=1.3×10-7,Ka2=7.1×10-15 ]。
(2)制备碱式碳酸铅的实验步骤如下:
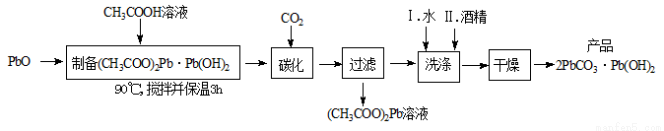
①“碳化”时,发生反应的化学方程式为 。
②“洗涤”时,经水洗涤后再用酒精洗涤的目的是 。
(3)为确定2PbCO3·Pb(OH)2(相对式量:775)的热分解过程,进行如下实验:称取一定量(2)实验制得的样品放在热重分析仪中,在氩气流中热分解,测得样品的固体残留率(固体样品的剩余质量/固体样品的起始质量×100%)随温度的变化如下图所示。
①A→B过程中,从体系中逸出的分解产物(化合物)为 (填化学式);C→D过程中,从体系中逸出的分解产物(化合物)为 (填化学式)。
②根据图中实验数据,计算并确定E点残留固体的化学式(写出计算过程)。
查看答案和解析>>
科目: 来源:2017届江苏省盐城市高三上学期期中化学试卷(解析版) 题型:实验题
Ca(H2PO2)2(次磷酸钙,一元中强酸H3PO2的钙盐)是一种白色结晶粉末,溶于水(常温时,溶解度16.7g/100g水),其水溶液呈现弱酸性。可用作医药、抗氧化剂以及制备次磷酸钠等。由白磷(P4)与石灰乳制备Ca(H2PO2)2的实验步骤如下:
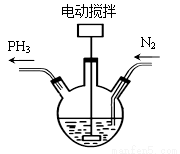
步骤1.在三口烧瓶中加入白磷和石灰乳,先通入N2,然后在约98°C下充分搅拌1h,同时收集产生的PH3。
步骤2.将反应液静置、过滤。
步骤3.向滤液中通入适量CO2,再过滤。
步骤4.用次磷酸溶液调节步骤3滤液的pH,浓缩、冷却结晶、干燥得次磷酸钙。
(1)步骤1先通入N2的目的是 ;搅拌的目的是 。
(2)步骤1石灰乳与 P4(白磷)发生反应的化学方程式为 ;步骤2过滤所得滤渣成分为 。
(3)步骤3的目的是 。
(4)请补充完整由产品进一步制备NaH2PO2·H2O的实验方案:取产品次磷酸钙加入烧杯中,加适量的水溶解, ,干燥得到NaH2PO2·H2O。(已知:在常压下,加热蒸发次磷酸钠溶液会发生爆炸,100℃时NaH2PO2·H2O的溶解度为667g/100g水)
查看答案和解析>>
科目: 来源:2017届江苏省盐城市高三上学期期中化学试卷(解析版) 题型:填空题
从含铜废料(如:覆铜板、印刷线路板及铅冰铜等)中提取铜,既可提高资源的利用率又可减少重金属污染。
(1)废覆铜板(Cu和Sn组成)可用CuSO4和H2SO4混合溶液作电解质溶液,直接电解回收精铜,阳极上发生的电极反应为 。
(2)废印刷线路板中的铜常用含盐酸的FeCl3溶液或H2O2-HCl- NaCl混合溶液浸取回收。
①用FeCl3溶液浸取铜时发生反应的离子方程式为 ;若加盐酸不足,反应一段时间后线路板表面有红褐色沉淀,产生红褐色沉淀的原因是 。
②将粉碎后的废印刷线路板放入三口烧瓶中,分别加入由0.3mol·L-1盐酸、0.5mol·L-1NaCl及不同浓度的H2O2组成的混合溶液,在温度、搅拌速率及固液比等均相同时,铜的浸取率随H2O2的浓度和时间的变化如图-1所示。当c(H2O2)= 0 mol·L-1时,也有少量的铜被浸出,其原因是 。
③用H2O2-HCl- NaCl混合溶液浸取时,其浸取过程包括:
(Ⅰ)Cu+H2O2+2H+=Cu2++2H2O
(Ⅱ)Cu2++Cu 2Cu+
2Cu+
(Ⅲ)Cu++nCl- CuCln(n-1)-
CuCln(n-1)-
(Ⅳ)2CuCln(n-1)-+2H++H2O2=2Cu2++2H2O+2nCl-
其他条件相同时,增大下列离子浓度可以加速Cu从废电路板中浸出的是 (填序号)。
a.Na+ b.Cu2+ c.Cl- d.OH-

(3)铅冰铜(PbS、Cu2S及FeS的混合物)可用HCl-H2O2混合溶液浸取。
①Cu2S被HCl-H2O2混合溶液浸取得到硫酸铜和氯化铜溶液的化学方程式为 。
②若由H2SO4代替HCl-H2O2中的HCl,其他条件相同,铜的浸取率随硫酸浓度的变化如图-2所示。当H2SO4浓度大于3.1mol·L-1时,硫酸浓度越大,铜的浸取率反而越小,其原因可能是 。
查看答案和解析>>
科目: 来源:2017届江苏省盐城市高三上学期期中化学试卷(解析版) 题型:填空题
亚硝酸盐与钴(Ⅲ)形成的一种配合物1Co(NH3)5NO2]Cl2的制备流程如下:

(1)Co2+基态核外电子排布式为 。
(2)配合物1Co(NH3)5Cl]Cl2中与Co3+形成配位键的原子为 (填元素符号);配离子 1Co(NH3)5NO2]2+的配体中氮原子的杂化轨道类型为 。
(3)与NO2-互为等电子体的单质分子为 (写化学式)。
(4)H2O2与H2O可以任意比例互溶,除因为它们都是极性分子外,还因为 。
(5)亚硝酸盐在水体中可转化为强致癌物亚硝胺,亚硝胺NDMA的结构简式如图所示,1molNDMA分子中含有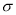 键的数目为 mol。
键的数目为 mol。

查看答案和解析>>
科目: 来源:2017届江苏省盐城市高三上学期期中化学试卷(解析版) 题型:实验题
氧化石墨烯(结构如图所示)是一种性能优异的新型碳材料。实验室制备氧化石墨烯的一种方法如下:

(1)将浓硫酸“冷却至0℃”可采用的方法是 。
(2) 步骤②采用100目鳞片状的石墨,其主要目的是 ;图示的“搅拌”方式为 。
(3)步骤③④中加NaNO3和KMnO4的作用是 。
(4)步骤⑧H2O2还原剩余的KMnO4反应的离子方程式为 ;检验洗涤已无SO42-的方法是 。
查看答案和解析>>
科目: 来源:2017届河北辛集中学高三上理综测试三化学试卷(解析版) 题型:选择题
取少量MgO、Al2O3、SiO2、Fe2O3的混合粉末,加入过量盐酸,充分反应后过滤,得到沉淀X和滤液Y。下列叙述中正确的是
A.上述四种氧化物对应的水化物中,Al(OH)3 酸性最强
B.向沉淀X中加入氢氟酸,沉淀X不溶解
C.溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+、H+
D.溶液Y中加入过量氨水,所得沉淀为Fe(OH)3和Mg(OH)2
查看答案和解析>>
科目: 来源:2017届河北辛集中学高三上理综测试三化学试卷(解析版) 题型:选择题
下列说法正确的是
A.配制硫酸亚铁溶液时,常向溶液加入少量稀硝酸和少量铁粉
B.用25.00mL碱式滴定管量取20.00mL酸性高锰酸钾溶液
C.用pH试纸检验气体的酸碱性时,一定要先用蒸馏水湿润
D.可以用洒精萃取碘水中的碘单质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com