
科目: 来源:2017届吉林省高三上摸底考试四化学卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.0.1 mol·L-1 NaOH溶液:K+、Na+、SO42-、CO32-
B.能与铝反应放出氢气的溶液中:K+、SO42-、NO3-、NH4+
C.0.1 mol·L-1 FeCl3溶液:K+、NH4+、I-、SCN-
D.c(H+)/c(OH-)=1×1014的溶液:Ca2+、Na+、ClO-、NO3-
查看答案和解析>>
科目: 来源:2017届吉林省高三上摸底考试四化学卷(解析版) 题型:选择题
下列关于有机化合物的说法错误的是
A.2,2-甲基丙烷也称新戊烷
B.由乙烯生成乙醇属于加成反应
C.分子式为C5H11Cl的有机物共有8种(不含立体异构)
D.所有的糖类、油脂、蛋白质都可以发生水解反应
查看答案和解析>>
科目: 来源:2017届吉林省高三上摸底考试四化学卷(解析版) 题型:选择题
X、Y、Z、R、W是5种短周期元素,原子序数依次增大;它们可组成离子化合物Z2Y和共价化合物RY3、XW4;已知Y、R同主族,Z、R、W同周期。下列说法错误的是
A. 原子半径:Z>R>Y
B. 气态氢化物稳定性:HmW>HnR
C. Y、Z、R三种元素组成的化合物水溶液一定显中性
D. X2W6分子中各原子均满足8电子结构
查看答案和解析>>
科目: 来源:2017届吉林省高三上摸底考试四化学卷(解析版) 题型:选择题
下列实验操作能达到目的的是
实验目的 | 实验操作 | |
A | 制备Fe(OH)3胶体 | 将NaOH浓溶液滴加到饱和FeCl3溶液中 |
B | 配制氯化铁溶液 | 将氯化铁溶解在较浓的盐酸中再加水稀释 |
C | 确定Na2SO3样品是否部分被 氧化 | 取样于试管中,加入稀硝酸酸化,再滴加BaCl2溶液,观察是否有白色沉淀生成 |
D | 检验乙醇发生消去反应生成 乙烯 | 将生成的气体直接通入盛有酸性高锰酸钾溶液的试剂瓶,观察溶液是否褪色 |
查看答案和解析>>
科目: 来源:2017届吉林省高三上摸底考试四化学卷(解析版) 题型:选择题
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,其总反应为:2CH2=CH2+O2→2CH3CHO。下列有关说法正确的是

A.该装置能量转化形式是电能转化为化学能
B.负极反应式为:CH2=CH2-2e-+H2O=CH3CHO +2H+
C.每有0.1 mol O2反应,则向负极迁移的H+的物质的量为0.4 mol
D.电子移动方向:电极a→磷酸溶液→电极b
查看答案和解析>>
科目: 来源:2017届吉林省高三上摸底考试四化学卷(解析版) 题型:选择题
已知常温时CH3COOH和NH3•H2O 的电离常数相等,现向10 mL浓度为0.1 mol•L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中下列说法正确的是
A.水的电离程度始终增大
B.c(NH4+)/c(NH3•H2O)先增大再减小
C.当加入氨水的体积为10 mL时,溶液中的离子浓度:c(NH4+)=c(CH3COO-)﹥c(H+)= c(OH-)
D.当加入氨水的体积为10 mL时,溶液中的pH=7,由水电离出的c(H+)=1×10-7
查看答案和解析>>
科目: 来源:2017届吉林省高三上摸底考试四化学卷(解析版) 题型:填空题
甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.58 kJ•mol-1
CH3OH(g)+H2O(g) △H1=-49.58 kJ•mol-1
反应Ⅱ:CO2(g)+H2(g) CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g) CH3OH(g) △H3=-90.77 kJ•mol-1
CH3OH(g) △H3=-90.77 kJ•mol-1
回答下列问题:
(1)反应Ⅱ的△H2= ,若反应Ⅰ、Ⅱ、Ⅲ平衡常数分别为K1、K2、K3,则K2= (用K1、K3表示)。
(2)反应Ⅲ自发进行条件是 (填“较低温度”、“较高温度”或“任何温度”)。
(3)在一定条件下2 L恒容密闭容器中充入3 mol H2和1.5 mol CO2,仅发生反应Ⅰ,实验测得不同反应温度与体系中CO2的平衡转化率的关系,如下表所示。
温度(℃) | 500 | T |
CO2的平衡转化率 | 60℅ | 40℅ |
①T 500℃(填“高于”或“低于”)。
②温度为500℃时,该反应10 min时达到平衡:
a.用H2表示该反应的速率为 ;
b.该温度下,反应I的平衡常数K= 。
(4)某研究小组将一定量的H2和CO2充入恒容密闭容器中并加入合适的催化剂(发生反应I、Ⅱ、Ⅲ),测得不同温度下体系达到平衡时CO2的转化率(a)及CH3OH的产率(b),如图所示。

①该反应达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是 (选填编号)。
A.升高温度 B.缩小容器体积 C.分离出甲醇 D.增加CO2的浓度
②据图可知当温度高于260℃后,CO的浓度随着温度的升高而 (填“增大”、“减小”、“不变”或“无法判断”)。
查看答案和解析>>
科目: 来源:2017届吉林省高三上摸底考试四化学卷(解析版) 题型:实验题
三氯氧磷(化学式:POCl3)常用作半导体掺杂剂及光导纤维原料。氯化水解法生产三氯氧磷的流程如下:

(1)氯化水解法生产三氯氧磷的化学方程式为___________________________。
(2)氯化水解法生产三氯氧磷时,会产生含磷(主要为H3PO3、H3PO4等)废水,已知H3PO3是一种淡黄色晶体,且易溶于水的二元弱酸。
①若用20 mL H3PO3溶液与同浓度的NaOH溶液40mL恰好完全反应,生成的盐为___________________(填“正盐”或“酸式盐”)。
②H3PO3中,P元素的化合价为_______________________。H3PO3可以将溶液中的Ag+还原,从而用于化学镀银,写出该离子方程式_________________________。
③处理废水时,先在其中加入适量漂白粉,再加入生石灰调节pH将磷元素转化为磷酸钙沉淀并回收,加入漂白粉的作用是______________________________________。
④若处理后的废水中c(PO43ˉ)=4×10ˉ7mol·Lˉ1,溶液中c(Ca2+)=________mol·Lˉ1。(已知Ksp[Ca3(PO4)2]=2×10ˉ29)
(3)通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
Ⅰ.取a g产品于锥形瓶中,加入足量NaOH溶液,待完全水解后加稀硝酸至酸性。
Ⅱ.向锥形瓶中加入0.1000 mol·Lˉ1的AgNO3溶液40.00 mL,使Cl-完全沉淀。
Ⅲ.向其中加入2 mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。
Ⅳ.加入指示剂,用c mol·Lˉ1 NH4SCN溶液滴定过量Ag+至终点,记下所用体积。
已知:Ksp(AgCl)=3.2×10ˉ10,Ksp(AgSCN)=2×10ˉ12
①滴定选用的指示剂是__________(选填字母)。
a.FeCl2b.NH4Fe(SO4)2 c.淀粉 d.甲基橙
②实验过程中若未加入硝基苯这项操作,所测Cl元素含量将会_______(填“偏大”、“偏小”或“不变”)。
查看答案和解析>>
科目: 来源:2017届吉林省高三上摸底考试四化学卷(解析版) 题型:填空题
我国铜矿资源分布广泛,已探明储量居世界第三位。铜元素常见价态为+1,+2。大多数+1价铜的化合物是难溶物,如:CuCl、Cu2O等。+1价铜在酸性条件下易发生反应:2Cu+= Cu2++Cu。
(1)CuCl通常用作催化剂、杀菌剂、媒染剂、脱色剂。某实验兴趣小组模拟制备CuCl。
方法一:在CuCl2溶液中逐滴加入KI溶液可能发生:2Cu2++2Cl-+2I-=2CuCl↓(白色)+I2,为顺利观察到白色沉淀可以加入的最佳试剂是 。
A.SO2 B.苯 C.NaOH溶液 D.乙醇
方法二:将Na2SO3溶液逐滴加入CuCl2溶液中再加入少量的浓盐酸混匀,倾出清液,过滤出沉淀,沉淀用无水乙醇多次洗涤,得白色粉末状固体。
①沉淀的过滤和洗涤均用到的玻璃仪器有 ;
②洗涤CuCl沉淀的操作为 。
(2)纳米级Cu2O具有特殊的光学、电学及光电化学性质,研究制备纳米氧化亚铜的方法成为当前的研究热点之一。
方法一:在新制Cu(OH)2浊液中滴入N2H4•H2O水溶液,蓝色沉淀逐渐转化为砖红色,同时产生无色无味的气体。写出上述制备过程中的化学反应方程式 ;
方法二:以铜作阳极,石墨作阴极,电解含有NaOH的NaCl水溶液。
已知:该电解过程中阳极先生成难溶物CuCl,再与NaOH反应转化为Cu2O。
①写出阳极的电极反应式 ;
②电解后溶液中c(OH-)会 (填“变大”、“变小”或“不变”);
③若电解电路中通过0.2 mol电子,理论上生成Cu2O的质量为 g。
查看答案和解析>>
科目: 来源:2017届吉林省高三上摸底考试四化学卷(解析版) 题型:填空题
三聚氰胺俗称“蛋白精”,工业上通过下列流程合成三聚氰胺。请回答下列问题:
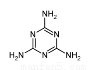
(1)基态Ca原子的电子排布式:___________________;CaC2的电子式________________。
(2)尿素分子中所含除氢以外元素第一电离能由小到大的顺序为________________。
(3)CaCN2中阴离子为CN22-,与CN22-互为等电子体的分子有N2O和________(填化学式),由此可以推知CN22-的空间构型为________。
(4)三聚氰胺分子中碳原子的杂化方式为________,分子中处于同一平面的氮原子有_____个。
(5)动物摄入三聚氰胺和三聚氰酸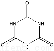 后,三聚氰酸与三聚氰胺分子相互之间通过________结合,在肾脏内易形成结石。
后,三聚氰酸与三聚氰胺分子相互之间通过________结合,在肾脏内易形成结石。
(6)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为______________,已知CaO晶体的密度为ρ,用NA表示阿伏伽德罗常数,求晶胞中距离最近的两个钙离子之间的距离__________(用含ρ、NA代数式表示)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com