
科目: 来源:2017届浙江省“七彩阳光”新高考研究联盟高三下学期期初联考化学试卷(解析版) 题型:简答题
钛白粉(金红石晶型 TiO2)被广泛用于制造高级白色油漆。工业上以钛铁矿(主要成分为 FeTiO3,含有 Fe2O3 和 SiO2 等杂质)为原料制钛白粉的主要工艺如下:

回答下列问题:
(1)第②步所得滤渣的成分是________。
(2)操作④中需要控制条件以形成 TiO2·nH2O 溶胶,该工艺过程若要在实验室里完成,其中的“过滤”操作,可选用下列装置________(填选项)。

(3)第③步的实验操作是______、过滤,从而获得副产品 FeSO4·7H2O。
(4)为测定操作③所得滤液中TiO2+的浓度,取待测滤液10 mL 用蒸馏水稀释至100 mL,加入过量铝粉,充分振荡,使其完全反应:3TiO2+ + Al + 6H+ = 3Ti3+ + Al3+ + 3H2O。过滤后,取出滤液20.00 mL(加铝粉时引起溶液体积的变化忽略不计),向其中滴加2~3 滴KSCN溶液作指示剂,用 0.1000 mol·L-1NH4Fe(SO4)2 标准溶液滴定至溶液出现红色,此时溶液中 Ti3+全部被氧化为 Ti4+,消耗标准液30.00mL。回答下列问题:
①下列操作会使所测 TiO2+浓度偏高的是______。
A. 在配制标准液的过程中,未洗涤烧杯和玻璃棒
B. 在配制标准液定容是俯视刻度线
C.用蒸馏水洗涤后未经润洗的滴定管取待测液
D.在滴定终点读数时仰视滴定管刻度线
②求得待测滤液中 TiO2+的物质的量浓度是______。
(5)科学家从电解冶炼铝的工艺中得到启发,找出了冶炼钛的新工艺—TiO2 直接电解法生产钛,电解质为熔融的氯化钙,原理如图所示。
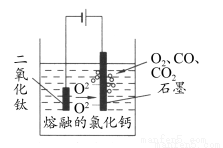
写出阴极电极反应式___________。
查看答案和解析>>
科目: 来源:2017届浙江省“七彩阳光”新高考研究联盟高三下学期期初联考化学试卷(解析版) 题型:计算题
G(异戊酸薄荷醇酯)是一种治疗心脏病的药物。其合成线路如下:
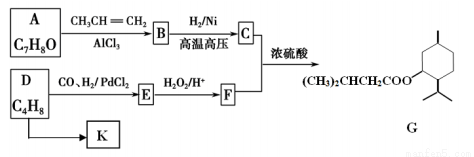
已知:①RCH=CH2+CO+H2 RCH2CH2CHO
RCH2CH2CHO
②A能与 FeCl3发生显色反应, K是高分子化合物
③
请填写下列空白:
(1)F中官能团名称_____,A到B的反应类型________。
(2)写出C和F反应生成G的化学方程式___________。
(3)下列说法正确的是_______。
A.有机物 G 的分子式为 C15H28O2
B.有机物 A 溶液能与 Na2CO3 溶液反应产生 CO2
C.有机物 C 不能与浓溴水反应生成白色沉淀
D.有机物 D 生成 K 的反应为缩聚反应
(4)某芳香族化合物 X是B的同分异构体,X分子中含有4种不同化学环境的氢原子,其对应的个数比为 9:2:2:1,写出该化合物可能的结构简式_________。
(5)正戊酸的化学式为CH3(CH2)3COOH,可用作香料、橡胶促进剂等,写出以正丁醇(CH3CH2CH2CH2OH)为原料制备正戊酸的合成路线流程图(无机试剂任用)。
__________
合成路线流程图示例如下:

查看答案和解析>>
科目: 来源:2017届黑龙江省牡丹江市高三2月开学检测理综化学试卷(解析版) 题型:选择题
化学与生产、生活密切相关。下列说法正确的是
A. 明矾净水原理不涉及化学变化
B. 现代科技已经能够拍到氢键的“照片”,直观地证实了水分子间的氢键是一个水分子中的氢原子与另一个水分子中的氧原子间形成的化学键
C. 在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质
D. 将单质铜制成“纳米铜”时,具有非常强的化学活性,在空气中可以燃烧,说明“纳米铜”的还原性比铜片更强
查看答案和解析>>
科目: 来源:2017届黑龙江省牡丹江市高三2月开学检测理综化学试卷(解析版) 题型:选择题
有机物甲、乙的结构如右图所示,下列说法错误的是

A. 甲、乙互为同分异构体
B. 甲、乙都能发生取代、加成和水解反应
C. 甲的一种同分异构体能发生银镜反应
D. 等物质的量的甲和乙与足量的NaOH溶液反应,消耗NaOH的物质的量相等
查看答案和解析>>
科目: 来源:2017届黑龙江省牡丹江市高三2月开学检测理综化学试卷(解析版) 题型:选择题
下列解释事实的化学方程式或离子方程式不正确的是
A. 向海带灰浸出液中加入硫酸、双氧水:2I-+2H++H2O2=I2+2H2O
B. 在燃煤中加入适量石灰石,可减少SO2的排放:2CaCO3+O2+2SO2═2CaSO3+2CO2
C. 自然界各种原生铜的硫化物经氧化、淋滤作用后产生的硫酸铜,遇到难溶的PbS,慢慢转变为铜蓝(CuS):Cu2++SO42-+PbS═CuS+PbSO4
D. 在盐碱地(含较多NaCl、Na2CO3)上通过施加适量CaSO4,可降低土壤的碱性:CaSO4+Na2CO3═CaCO3↓+Na2SO4
查看答案和解析>>
科目: 来源:2017届黑龙江省牡丹江市高三2月开学检测理综化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值,下列有关说法正确的是
A. 在1L 0.1mol/L的Na2CO3溶液中,阴离子总数小于0.1NA
B. 将1 mol NH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA
C. 标准状况下,2.24L甲醇中含有C—H键的数目为0.3NA
D. 将1mol Cl2通入水中,HClO、Cl-、ClO-粒子数之和为2NA
查看答案和解析>>
科目: 来源:2017届黑龙江省牡丹江市高三2月开学检测理综化学试卷(解析版) 题型:选择题
短周期元素W、X、Y、Z的原子序数依次增大,W的单质是空气中体 积分数最大的气体,W与Y最外层电子数之和为X最外层电子数的2倍,X、Y、Z简单离子的电子层结构相同,Z最外层电子数等于最内层电子数。下列说法正确的是
A. 单质Z可用海水作原料获得
B. W的简单气态氢化物比Y的简单气态氢化物稳定
C. 原子半径由大到小的顺序:Z、Y、X、W
D. WX与ZX中的化学键类型相同
查看答案和解析>>
科目: 来源:2017届黑龙江省牡丹江市高三2月开学检测理综化学试卷(解析版) 题型:选择题
下列实验“操作和现象”与“结论”及对应关系均正确的是
实验操作、现象 | 实验结论 | |
A | 将FeCl3溶液分别滴入NaBr、NaI溶液中,再分别滴加CCl4,振荡,静置后CCl4层均有颜色 | 氧化性:Fe3+>Br2>I2 |
B | 向某溶液中加入盐酸酸化的氯化钡溶液,出现白色沉淀 | 该溶液中一定含有大量SO42- |
C | 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有少量气泡产生 | 证明常温下 Ksp(BaCO3)>Ksp(BaSO4) |
D | 除锈的铁钉在浓硝酸中浸泡后,用蒸馏水洗净,再放入CuSO4溶液中无现象 | 铁钉表面形成了一层致密稳定的氧化膜 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源:2017届黑龙江省牡丹江市高三2月开学检测理综化学试卷(解析版) 题型:选择题
常温下,向20 mL 0.01 mol/L CH3COOH溶液中逐滴加入0.01 mol/L 的NaOH溶液,溶液中水所电离出的c(H+)随加入NaOH溶液的体积变化示意图如下,下列说法正确的是
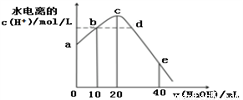
A. 从a到c,对醋酸的电离既有促进作用也有抑制作用
B. b、d两点溶液的pH相同
C. e点所示溶液中,c(Na+)=2c(CH3COO-)+2c(CH3COOH) = 0.01mol/L
D. 从b→d的过程中,既存在pH=7的点也存在水电离的c(H+)=10-7的点
查看答案和解析>>
科目: 来源:2017届黑龙江省牡丹江市高三2月开学检测理综化学试卷(解析版) 题型:实验题
工业上常通过高温分解FeSO4的方法制备Fe2O3,为检验FeSO4高温分解的产物,并进行有关探究实验,回答下列问题:
实验一:高温分解FeSO4,利用如图所示的实验装置进行实验。
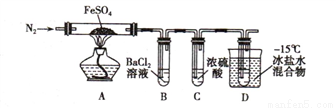
已知:①SO2熔点为-72℃,沸点为-10℃ ② SO3熔点为-16.8℃,沸点为44.8℃
(1)连接装置,检验气密性良好,放入药品,通入一段时间N2然后加热,通入N2的目的是_________________________
(2)隔绝空气加热至650℃,看到B中有白色沉淀,D试管中有无色液体,硬质玻璃管中的固体变为_________色,写出该反应的化学方程式___________________。
(3)反应完毕后,停止加热冷却后,取硬质玻璃管中固体,加盐酸,反应的离子方程式是__________________, 将反应后所得溶液滴入D试管中,溶液变为浅绿色,该反应的离子方程式是 _______________
实验二 探究高温分解 FeSO4生成的气体
(4)用如图所示装置设计实验,验证高温分解FeSO4生成的气态物质
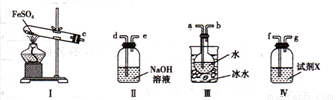
①按气流方向连接各仪器,用字母表示接口的连接顺序:c-__________________________
②试剂X的名称是 ___________________________
③充分反应后,利用装置III中圆底烧瓶内混合物测定已分解的FeSO4 的质量,向圆底烧瓶中逐渐滴入氯化钡溶液,直到沉淀完全;然后过滤混合物,在过滤器上将沉淀洗净后,烘干并冷却至室温,称重。若最终得到沉淀的质量为Wg ,则已分解的FeSO4的质量 ________________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com