
科目: 来源:2016-2017学年安徽省六安市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列反应的离子方程式书写正确的是( )
A. 4mol/L的NaAlO2溶液和7mol/L的HCl等体积互相均匀混合4AlO2-+7H++H2O=3Al(OH)3↓+Al3+
B. 硫酸氢钠溶液与氢氧化钡溶液混合显中性:H++SO42ˉ+Ba2++OH-===H2O+BaSO4↓
C. 稀硝酸中加入过量的铁粉:Fe+4H++NO3-=Fe3++NO↑+2H2O
D. 向AlCl3溶液中加入过量氨水: Al3++4NH3·H2O= AlO2-+4NH4++2H2O
查看答案和解析>>
科目: 来源:2016-2017学年安徽省六安市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列图像能表示相关反应中生成物物质的量的变化的是(横、纵坐标单位:mol) ( )
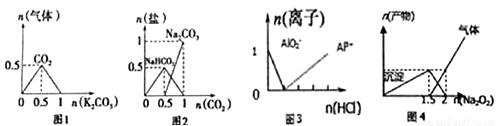
A. 图1: n (HCl)=1mol,K2CO3加入到HCl溶液中,在敝口容器中生成的气体
B. 图2 : n(NaOH)=1mol,CO2通入到NaOH溶液中反应生成的盐
C. 图3 :n(NaAlO2)=1mol,HCl加入到NaAlO2溶液中离子的存在情况
D. 图4 : n(AlCl3)=1mol, Na2O2加入AlCl3溶液反应的产物
查看答案和解析>>
科目: 来源:2016-2017学年安徽省六安市高一上学期期末考试化学试卷(解析版) 题型:选择题
把500mLNH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入含amol氢氧化钠的溶液加热,恰好使NH4+完全转化为NH3逸出,另取一份加入含bmolHCl的盐酸恰好反应完全,则该混合溶液中c(Na+)为( )
A. (2b-a)mol/L B. (10b-5a)mol/L C. (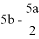 )mol/L D. (
)mol/L D. (  ) mol/L
) mol/L
查看答案和解析>>
科目: 来源:2016-2017学年安徽省六安市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列实验方案中,能测定Na2CO3和NaHCO3混合物中NaHCO3质量分数的是( )
① 取a克混合物充分加热,减轻b克② 取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体③ 取a 克混合物与足量稀硫酸充分反应,逸出气体先用浓硫酸干燥再用碱石灰吸收,碱石灰增重b克
④取a 克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体
A. 只有①②④ B. ①②③④ C. 只有①③④ D. 只有①②③
查看答案和解析>>
科目: 来源:2016-2017学年安徽省六安市高一上学期期末考试化学试卷(解析版) 题型:选择题
某溶液中可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Fe2+、Al3+、Na+。某同学为了确认其成分,取部分试液,设计并完成了如下实验:
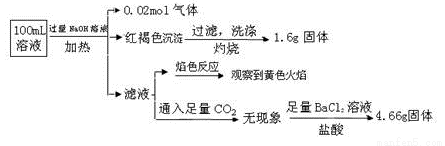
下列说法正确的是( )
A. 原溶液中c(Fe3+)=0.2 mol•L-1
B. 溶液中至少有4种离子存在,其中Cl-一定存在,且c(Cl-)≥0.2 mol·L-1
C. SO42ˉ、NH4+、Na+一定存在,CO32ˉ一定不存在
D. 要确定原溶液中是否含有Fe2+,其操作为:取少量原溶液于试管中,加入适量氯水,无现象,再加KSCN溶液,溶液成血红色,则含有Fe2+
查看答案和解析>>
科目: 来源:2016-2017学年安徽省六安市高一上学期期末考试化学试卷(解析版) 题型:简答题
I.对于混合物的分离或提纯,常采用的方法有:①过滤、②蒸发、③蒸馏、④萃取、⑤加热分解等。下列各组混合物的分离或提纯应采用什么方法?(填序号)
(1)提取碘水中的碘______。
(2)除去食盐溶液中的水______。
(3)淡化海水______。
(4)KCl中含有KClO3 ______。
II.根据以下装置图,回答下列问题:
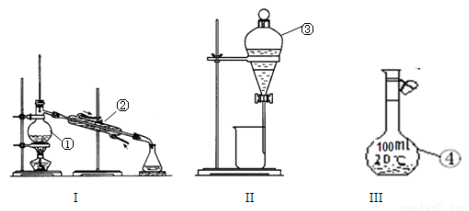
写出仪器名称②______③______;仪器①~④中,使用时必须检查是否漏水的有______(填序号)。
III.某课外活动小组设计下列实验装置,验证“二氧化碳与水接触时才能和过氧化钠反应”。
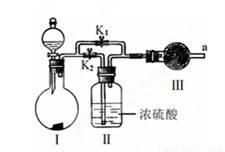
(1)过氧化钠与水反应的化学方程式是______。
(2)装置I是制备纯净的______(填化学式)。则装置I中最适宜的试剂组合是__(填字母) 。
a. 稀盐酸 b.稀硫酸 c.小苏打 d.石灰石
(3)实验时,应先打开弹簧夹K2,关闭K1,观察到预期现象后,打开K1,再关闭K2。
(4)实验过程中将带火星的木条置于a口,观察到带火星的木条始终不复燃。
①为观察到最终木条复燃,甲建议在Ⅲ后安装一个盛有碱石灰的干燥管,目的是______;
②乙认为即使采纳甲的建议且最终观察到木条复燃,也不能证明CO2参与了反应,原因是______。
查看答案和解析>>
科目: 来源:2016-2017学年安徽省六安市高一上学期期末考试化学试卷(解析版) 题型:填空题
(1)向某NaOH溶液中投入一块Al箔,先无明显现象,随后逐渐产生气泡,则产生气泡的离子反应方程式为______。
(2)实验室常用还原性Fe粉与水蒸气反应的实验来研究Fe的还原性,则该反应的化学反应方程式为______
(3)Fe(OH)2制备时,采用的方法是“长滴管、液面下”的实验操作,但在实验时,由于操作不当,依旧会出现白色沉淀、灰绿色沉淀直至最终变为红褐色沉淀,写出白色沉淀最终转化为红褐色沉淀的化学反应方程式为______
(4)实验时制备Al(OH)3时,常用可溶性铝盐(如Al2(SO4)3与氨水反应进行制备。某课外小组在实验时不慎向Al2(SO4)3溶液中加入了过量NaOH溶液,最终并没有制出白色沉淀Al(OH)3,则该小组同学实验时发生的总离子反应方程式为____。
查看答案和解析>>
科目: 来源:2016-2017学年安徽省六安市高一上学期期末考试化学试卷(解析版) 题型:计算题
向100 mLNaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入2.0 mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。
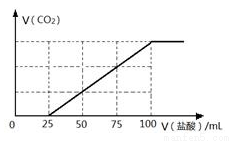
回答下列问题:
(1)原NaOH溶液的物质的量浓度为______ mol/L;
(2)题中通入CO2后所得溶液的溶质成分为______将所得溶质在低温低压条件下蒸干,所得固体物质(不带结晶水)的质量为_______ g。
查看答案和解析>>
科目: 来源:2016-2017学年安徽省六安市高一上学期期末考试化学试卷(解析版) 题型:推断题
某课外小组研究铝土矿中Al2O3的含量。已知铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下:

(1)固体B的主要用途有(写出1条即可)_______。
(2)第①步,向铝土矿中加入足量烧碱溶液后,发生反应的离子方程式是_____;_____;第③步中,生成氢氧化铝的离子方程式是______。
(3)将实验过程中所得固体精确称量,课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,则该铝土矿中Al2O3的质量分数是______(保留一位小数)
(4)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,每消耗0.5 mol 碳单质,转移1mol电子,反应的化学方程式是______。
查看答案和解析>>
科目: 来源:2016-2017学年安徽省六安市高一上学期期末考试化学试卷(解析版) 题型:实验题
氮化铝(AlN)是一种新型无机非金属材料,为了分析某AlN样品(样品中的杂质不与NaOH溶液反应)中AlN的含量,某实验小组设计了如下两种实验方案。已知:AlN+NaOH+H2O=NaAlO2+NH3↑
【方案1】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。
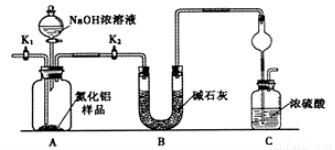
(1)上图C装置中球形干燥管的作用是________________________。
(2)完成以下实验步骤:组装好实验装置,首先检查装置的气密性,再加入实验药品。接下来的实验操作是________,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是_______________。
(3)由于上述装置还存在缺陷,导致测定结果偏高,请提出改进意见_________________。
【方案2】按以下步骤测定样品中A1N的纯度:
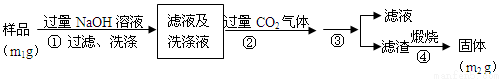
(4)步骤②生成沉淀的离子方程式为___________________。
(5)步骤③的操作是__________。A1N的纯度是___________(用m1、m2表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com