
科目: 来源:2017届江苏省高三下学期期初考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A. 向氨水中不断通入CO2,随着CO2的增加,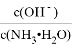 不断减小
不断减小
B. 在铜的精炼过程中,若转移1mol电子,则阳极一定溶解32gCu
C. 常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)的△H>0,△S<0
D. 将下图中的活塞快速推至A处固定,气体颜色先变深、再变浅,但比起始时深
查看答案和解析>>
科目: 来源:2017届江苏省高三下学期期初考试化学试卷(解析版) 题型:选择题
化合物丙是制刎备液晶材料的中间体之一,它可由甲和乙在一定条件下制得
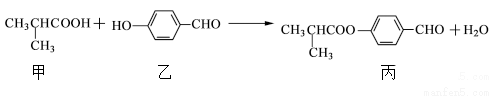
下列说法正确的是
A. 丙的分子式为C11H11O3
B. 甲分子中含有1个手性碳原子
C. 乙、丙各1mol分別和氢气反应,最多消耗氢气均为4mol
D. 丙可发生加成反应、取代反应、氧化反应等
查看答案和解析>>
科目: 来源:2017届江苏省高三下学期期初考试化学试卷(解析版) 题型:选择题
下列根据实验操作或现象得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | KBrO3溶液中加入少量苯,然后通入少量Cl2,有机相呈橙色 | 氧化性:Cl2>Br2 |
B | 室温下,向浓度均为0.1mol•L-1的KCl和KI混合溶液中滴加几滴AgNO3溶液,只出现黄色沉淀 | Ksp(AgI)<Ksp(AgCl) |
C | 向1mL1%的NaOH溶液中加入2mL2%的CuSO4溶液,振荡后再加入0.5mL有机物Y,加热,未出现砖红色沉淀。 | Y中不含有醛基 |
D | 已知NaClO2溶液的pH>7,将其蒸干并灼烧得到固体残留物。 | 该固体为NaClO2 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源:2017届江苏省高三下学期期初考试化学试卷(解析版) 题型:选择题
下列有关物质的浓度关系正确的是
A. 0.1mol•L-1HCl溶液与0.2mol•L-1氨水等体积混合(pH﹥7):c(NH4+)>c(Cl-)>c(NH3·H2O)>c(OH-)
B. Na2CO3溶液中:c(Na+)<c(CO32-)+c(HCO3-)
C. c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4)>c(NH4Cl)>c((NH4)2SO4)
D. 0.1mol•L-1 (NH4)2Fe(SO4)2溶液中:c(NH4+)+c(NH3·H2O)+c(Fe2+)=0.3mol•L-1
查看答案和解析>>
科目: 来源:2017届江苏省高三下学期期初考试化学试卷(解析版) 题型:选择题
已知:CO(g)+H2O(g) CO2(g)+H2(g) △H=-41kJ•mol-1相同温度下,在体积相同的两个恒温密闭容器中,加入一定量的反应物发生反应.相关数据如下:
CO2(g)+H2(g) △H=-41kJ•mol-1相同温度下,在体积相同的两个恒温密闭容器中,加入一定量的反应物发生反应.相关数据如下:
容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系能量的变化 | |||
CO | H2O | CO2 | H2 | ||
① | 1 | 4 | 0 | 0 | 放出热量:32.8 kJ |
② | 0 | 0 | 1 | 4 | 热量变化:Q |
下列说法中正确的是
A. 容器①中反应达平衡时,CO的转化率为80%
B. 平衡时,若向容器①中再加入0.2molCO和0.2molCO2,则V正<V逆
C. Q=8.2
D. 容器①中CO的转化率与容器②中CO2的转化率之和为1
查看答案和解析>>
科目: 来源:2017届江苏省高三下学期期初考试化学试卷(解析版) 题型:简答题
七铝十二钙是新型的超导材料和发光材料,用白云石(主要含CaCO3和MgCO3)和废Al片制备七铝十二钙的工艺如下:

(1)煅粉主要含__________,该工艺中不能用(NH4)2SO4代替NH4NO3,原因是_________。
(2)滤液I中主要的阴离子有_________;若滤液I中仅通入CO2,会生成________,从而导致CaCO3产率降低。
(3)用NaOH溶液可除去废Al片表面的氧化膜,反应的离子方程式为______________。
(4)电解制备Al(OH)3时,电极分别为Al片和石墨,电解总反应方程式为_______________。
查看答案和解析>>
科目: 来源:2017届江苏省高三下学期期初考试化学试卷(解析版) 题型:简答题
某重要香料F的合成路线有多条,其中一条合成路线如下

请回答下列问题:
(1)化合物E中含氧官能团的名称为______、__________。
(2)在(a)~(e)反应中,属于取代反应是____。(填编号)
(3)写出E→F的化学反应方程式_______。
(4)写出同时满足下列四个条件的D的一种同分异构体结构简式:_____________。
①该物质属于芳香族化合物
②该分子中有4种不同化学环境的氢原子
③1mol该物质最多可消耗2molNaOH
④该物质能发生银镜反应。
(5)根据已有知识并结合相关信息,已知:
写出以乙醇和 为原料制备
为原料制备 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_____________
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_____________
查看答案和解析>>
科目: 来源:2017届江苏省高三下学期期初考试化学试卷(解析版) 题型:简答题
工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)制取无水氯化铝的一种工艺流程示意如下:
已知:
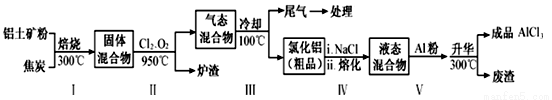
物质 | SiCl4 | AlCl3 | FeCl3 | FeCl2 |
沸点/℃ | 57.6 | 180(升华) | 300(升华) | 1023 |
(1)步骤Ⅰ中焙烧使固体水分挥发、气孔数目增多,其作用是_________________(只要求写出一种)。
(2)步骤Ⅱ中若不通入氯气和氧气,则反应生成相对原子质量比硅大的单质是________________。
(3)结合流程及相关数据分析,步骤V中加入铝粉的目的是________________。
(4)称取含Fe2O3和Al2O3的试样0.2000g,将其溶解在pH=2.0的热溶液中(50℃左右),以磺基水杨酸为指示剂,用0.02000 mol/L EDTA标准溶液滴定试样中的Fe3+,用去18.00 mL。然后将试液调至pH=3.5,加入上述EDTA标准溶液25.00 mL,并加热煮沸,使Al3+与EDTA完全反应,再调试液pH=4.5,以PAN(1-(2-吡啶偶氨)-2-萘酚)为指示剂,趁热用CuSO4标准溶液(每毫升含CuSO4·5H2O 0.005000g)返滴定,用去8.00 mL。计算试样中Fe2O3和Al2O3的质量分数。________________(写出计算过程)
(已知:EDTA与Fe3+、Al3+、Cu2+均按物质的量之比1∶1进行反应)
查看答案和解析>>
科目: 来源:2017届江苏省高三下学期期初考试化学试卷(解析版) 题型:简答题
以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,实现铅的再生利用。其工作流程如下:

(1)过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是_________。
(2)过程Ⅰ中,Fe2+催化过程可表示为:
i:2Fe2++PbO2+4H++SO42-═2Fe3++PbSO4+2H2O
ii:……
①写出ii的离子方程式:______________________。
②下列实验方案可验证上述催化过程.将实验方案补充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红。
b.____________。
(3)PbO溶解在NaOH溶液中,其溶解度曲线如图1所示。

①过程Ⅱ的目的是脱硫。滤液1经处理后可在过程Ⅱ中重复使用,其目的是___(选填序号)。
A.减小PbO的损失,提高产品的产率
B.重复利用NaOH,提高原料的利用率
C.增加Na2SO4浓度,提高脱硫效率
②过程Ⅲ的目的是提纯,结合上述溶解度曲线,简述过程Ⅲ的操作:_________。
查看答案和解析>>
科目: 来源:2017届江苏省高三下学期期初考试化学试卷(解析版) 题型:简答题
用零价铁(Fe)进行水体脱氮、(去除水体中的NO3-),已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。其中作负极的物质是________,正极的电极反应式是_________。

(2)研究表明,零价铁脱氮后最终会在表面生成不导电的FeO(OH)外皮,从而使得脱氮过程停止。补充一定量的Fe2+可以明显提高NO3-的去除率。对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3-;Ⅱ. Fe2+破坏FeO(OH)氧化层。
针对假设I:做对比实验,结果如图所示,可得到的结论是_______。
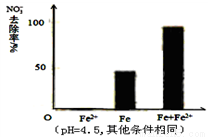
②针对假设II:以同位素示踪法,证实Fe2+能与FeO(OH)反应生成Fe3O4。该反应的离子方程式为_______________,加入Fe2+提高NO3-去除率的原因:____________。
(3)将足量铁粉投入水体中,测定不同初始pH对脱氧的影响见下边左图,初始PH为2.5时氮浓度与pH变化见下边图。结合两图分析,不同初始pH对脱氮产生影响的原因为_________________。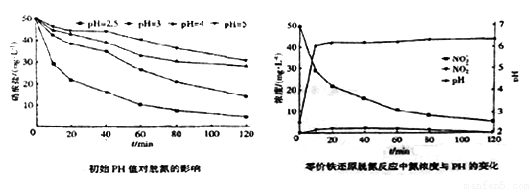
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com