
科目: 来源:2016-2017学年河北省张家口市高二上学期期末考试化学试卷(解析版) 题型:简答题
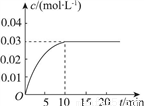
向一容积为5L的恒容密闭容器内,充入0.2molCO和0.4molH2O,在一定条件下发生反应:CO(g)+H2O(g) CO2(g)+H2(g) ΔH>0。反应中CO2的浓度(c)随时间(t)的变化关系如图所示。
CO2(g)+H2(g) ΔH>0。反应中CO2的浓度(c)随时间(t)的变化关系如图所示。
回答下列问题:
(1)下列叙述能判断该反应达到平衡状态的是________(填序号)。
①H2O的质量不再变化
②混合气体的总压强不再变化
③CO、H2O、CO2、H2的浓度都相等
④单位时间内生成amolCO,同时生成amolH2
(2)0~10min时段,反应速率v(H2)=________;反应达到平衡时,c(H2O)=________,CO的转化率为________。
查看答案和解析>>
科目: 来源:2016-2017学年河北省张家口市高二上学期期末考试化学试卷(解析版) 题型:简答题
Ⅰ.室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略混合后溶液的体积变化),实验数据如下表:
实验序号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
请回答:
(1)HA溶液和KOH溶液反应的离子方程式为________。
(2)实验①反应后的溶液中由水电离出的c(OH-)=________mol·L-1;x________0.2mol·L-1(填“>”“<”或“=”)。
(3)下列关于实验②反应后的溶液说法不正确的是________(填字母)。
a.溶液中只存在着两个平衡
b.溶液中:c(A-)+c(HA)>0.1mol·L-1
c.溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
Ⅱ.已知2H2(g)+O2(g)=2H2O(1) ΔH=-572kJ·mol-1。某氢氧燃料电池以疏松多孔石墨棒为电极,KOH溶液为电解质溶液。
(4)写出该电池工作时负极的电极反应式________。
(5)若该氢氧燃料电池每释放228.8kJ电能时,会生成1mol液态水,则该电池的能量转化率为________。
查看答案和解析>>
科目: 来源:2016-2017学年河北省张家口市高二上学期期末考试化学试卷(解析版) 题型:简答题
环境监测显示,某地市的主要气体污染物为SO2、NOx、CO等,其主要来源为燃煤、机动车尾气。进行如下研究:
(1)为减少燃煤对SO2的排放,可将煤转化为清洁燃料水煤气(CO和H2)。
已知: ΔH=241.8kJ·mol-1,
ΔH=241.8kJ·mol-1,
 ΔH=-110.5kJmol-1
ΔH=-110.5kJmol-1
写出焦炭与1mol水蒸气反应生成水煤气的热化学方程式:________。
(2)汽车尾气中NO是在发动机汽缸中生成的,反应为N2(g)+O2(g) 2NO(g) ΔH>0。
2NO(g) ΔH>0。
①将含0.8molN2和0.2molO2(近似空气组成)的混合气体充入某密闭容器中,保持1300℃反应达到平衡,测得生成8×10-4molNO。计算该温度下此反应的化学平衡常数K=________(填近似计算结果)。
②汽车启动后,汽缸内温度越高,单位时间内NO排放量越大,原因是________.
(3)利用如图所示装置(电极均为惰性电极)可吸收SO2,并利用阴极排出的溶液吸收NO2。
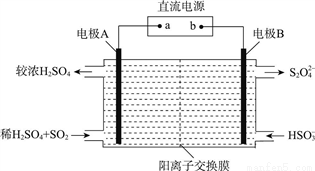
①电极A的电极反应式为________;
电极B的电极反应式为________。
②碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时生成SO32-。该反应的离子方程式为________。
查看答案和解析>>
科目: 来源:2016-2017学年河北省张家口市高二上学期期末考试化学试卷(解析版) 题型:简答题
Ⅰ.常温下,将除去表面氧化膜的Al、Cu片放入U形管作原电池的两极,测得图1所示原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生。
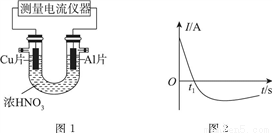
(1)0~t1时,原电池的负极是Al片,此时,正极的电极反应式是________。溶液中的H+向________(填“正”或“负”)极移动。
(2)t1时,原电池中电子流动方向发生改变,其原因是________。
Ⅱ.下图所示电化学装置中,a为足量的电解质溶液,X、Y是两块电极板。

请回答:
(3)若X、Y都是石墨电极,a是含有酚酞的饱和NaCl溶液,则在X电极附近观察到的现象是________,检验Y电极上反应产物的化学方法及实验现象是________,电解池总反应的离子方程式为________。
查看答案和解析>>
科目: 来源:2016-2017学年河北省张家口市高二上学期期末考试化学试卷(解析版) 题型:实验题
已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。
某化学小组根据上述反应原理进行下列实验:
Ⅰ.测定H2C2O4溶液的物质的量浓度
实验步骤如下:
①取待测H2C2O4溶液25.00mL放入锥形瓶中,再加入适量的稀硫酸;
②用0.1mol·L-1KMnO4溶液滴定至终点,记录数据;
③重复滴定2次,平均消耗KMnO4溶液20.00mL。
请回答:
(1)滴定时,将KMnO4溶液装在________(填“酸式”或“碱式”)滴定管中。
(2)若在步骤①操作之前,先用待测H2C2O4溶液润洗锥形瓶,则测得H2C2O4溶液的浓度会________(填“偏大”“偏小”或“无影响”)。
(3)步骤②中到达滴定终点时的现象为________。
(4)计算H2C2O4溶液的物质的量浓度为________mol·L-1。
Ⅱ.探究反应物浓度对化学反应速率的影响设计如下实验方案(实验温度均为25℃):
实验序号 | 体积V/mL | |||
0.1mol·L-1KMnO4溶液 | 0.1mol·L-1H2C2 O4溶液 | 0.1mol·L-1H2SO4溶液 | H2O | |
① | 2.0 | 5.0 | 6.0 | 7.0 |
② | 2.0 | 8.0 | 6.0 | V1 |
③ | 2.0 | V2 | 6.0 | 2.0 |
请回答:
(5)表中V1=________,V2=________。
(6)实验中需要测量的数据是________。
(7)实验中________(填“能”或“不能”)用0.2mol·L-1盐酸代替0.1mol·L-1H2SO4溶液,理由是________。
查看答案和解析>>
科目: 来源:2016-2017学年福建省漳州市高二上学期期末考试化学试卷(解析版) 题型:选择题
已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如下图所示。下列说法正确的是( )
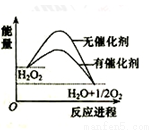
A. 加入催化剂,减小了反应的热效应
B. 加入催化剂,可提高H2O2的平衡转化率
C. H2O2分解的热化学方程式:2H2O2 = 2H2O + O2 ΔH>0
D. 反应物的总能量高于生成物的总能量
查看答案和解析>>
科目: 来源:2016-2017学年福建省漳州市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列关于反应热的描述中正确的是
A. 由H+(aq)+OH-(aq)===H2O(l)ΔH=-57.3 kJ·mol-1可知:含1 mol CH3COOH的溶液与含1 mol NaOH的溶液混合,放出热量为57.3 kJ
B. 由C(石墨,s)===C(金刚石,s) ΔH=1.9 kJ·mol-1,可知:石墨比金刚石更稳定
C. 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g) 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
D. 甲烷的标准燃烧热(ΔH)为-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
查看答案和解析>>
科目: 来源:2016-2017学年福建省漳州市高二上学期期末考试化学试卷(解析版) 题型:选择题
通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。现给出化学键的键能如下:
化学键 | H—H | Cl—Cl | Cl—H |
键能/(kJ·mol-1) | 436 | 243 | 431 |
请计算H2(g)+Cl2(g) === 2HCl(g)的反应热
A. +862 kJ·mol-1 B. +679 kJ·mol-1 C. -183 kJ·mol-1 D. +183 kJ·mol-1
查看答案和解析>>
科目: 来源:2016-2017学年福建省漳州市高二上学期期末考试化学试卷(解析版) 题型:选择题
H2S(g)+ O2(g)===SO2(g)+H2O(g)ΔH1
O2(g)===SO2(g)+H2O(g)ΔH1
2H2S(g)+SO2(g)=== S2(g)+2H2O(g)ΔH2
S2(g)+2H2O(g)ΔH2
H2S(g)+ O2(g)===S(g)+H2O(g)ΔH3 2S(g)===S2(g)ΔH4
O2(g)===S(g)+H2O(g)ΔH3 2S(g)===S2(g)ΔH4
则ΔH4的正确表达式为
A. ΔH4= (ΔH1+ΔH2-3ΔH3) B. ΔH4=
(ΔH1+ΔH2-3ΔH3) B. ΔH4= (3ΔH3-ΔH1-ΔH2)
(3ΔH3-ΔH1-ΔH2)
C. ΔH4= (ΔH1+ΔH2-3ΔH3) D. ΔH4=
(ΔH1+ΔH2-3ΔH3) D. ΔH4= (ΔH1-ΔH2-3ΔH3)
(ΔH1-ΔH2-3ΔH3)
查看答案和解析>>
科目: 来源:2016-2017学年福建省漳州市高二上学期期末考试化学试卷(解析版) 题型:选择题
锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是
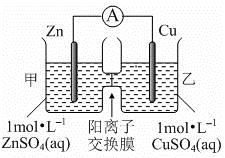
A. 铜电极上发生氧化反应
B. 电池工作一段时间后,甲池的c(SO42-)减小
C. 电池工作一段时间后,乙池溶液的总质量增加
D. 阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com