
科目: 来源:2016-2017学年宁夏银川市高二下学期第一次月考化学试卷(解析版) 题型:选择题
下列说法中正确的是
A. 在一个原子里找不到两个能量基本相同的电子
B. 在L层运动的电子能量一定比M层运动的电子能量要大
C. 第一电离能与电负性呈周期性变化取决于元素原子核外电子排布的周期性变化
D. 根据各电子层最多容纳电子数目是2n2的规律,钾原子的M层应有2×32个电子
查看答案和解析>>
科目: 来源:2016-2017学年宁夏银川市高二下学期第一次月考化学试卷(解析版) 题型:选择题
下列有关杂化轨道的说法不正确的是
A. 原子中能量相近的某些轨道,在成键时能重新组合成能量相等的新轨道
B. 轨道数目杂化前后可以相等,也可以不等
C. 杂化轨道成键时,要满足原子轨道最大重叠原理、最小排斥原理
D. 杂化轨道可分为sp、sp2、sp3杂化等
查看答案和解析>>
科目: 来源:2016-2017学年宁夏银川市高二下学期第一次月考化学试卷(解析版) 题型:选择题
已知短周期元素X、Y、Z在元素周期表中的位置如下图,下列说法正确的是( )

A. 原子半径:Z>Y>X
B. X元素属于第二周期
C. 气态氢化物的稳定性:X>Y>Z
D. 最高价氧化物对应水化物的酸性:Y>Z>X
查看答案和解析>>
科目: 来源:2016-2017学年宁夏银川市高二下学期第一次月考化学试卷(解析版) 题型:选择题
钡在氧气中燃烧时得到一种钡的氧化物晶体,结构如图所示,有关说法不正确的是

A.该晶体属于离子晶体
B.晶体的化学式为Ba2O2
C.该晶体晶胞结构与NaCl相似
D.与每个Ba2+距离相等且最近的Ba2+共有12个
查看答案和解析>>
科目: 来源:2016-2017学年宁夏银川市高二下学期第一次月考化学试卷(解析版) 题型:选择题
观察下列模型并结合有关信息进行判断,下列说法错误的是
HCN | S8 | |
结构模型示意图 |
|
|
备注 | - | 易溶于CS2 |
SF6 | B12结构单元 | |
结构模型示意图 |
|
|
备注 | - | 熔点1873K |
A. HCN的结构式为H—C≡N
B. 固态硫S8属于原子晶体
C. SF6是由极性键构成的非极性分子
D. 单质硼属原子晶体,结构单元中含有30个B—B键,含20个正三角形
查看答案和解析>>
科目: 来源:2016-2017学年宁夏银川市高二下学期第一次月考化学试卷(解析版) 题型:选择题
A、B、C、D四种元素,已知A元素是地壳中含量最多的元素;B元素为金属元素,它的原子核外K、L层上电子数之和等于M、N层电子数之和;C元素是第三周期第一电离能最小的元素;D元素在第三周期中第一电离能最大。下列有关叙述错误的是( )
A. 四种元素A、B、C、D分别为O、Ca、Na、Ar
B. 元素A、B、C两两组成的化合物可为CaO、CaO2、Na2O、Na2O2等
C. 元素A、C简单离子的半径大小关系为A<C
D. 元素B、C电负性大小关系为B>C
查看答案和解析>>
科目: 来源:2016-2017学年宁夏银川市高二下学期第一次月考化学试卷(解析版) 题型:填空题
(6分)现有下列几种常见的物质:①N2 ②NaCl ③Ca(OH)2 ④金刚石⑤SiC ⑥NH3
⑦NH4Cl ⑧CO2。其中,(以下空格均填写序号)
(1)含有非极性键的分子晶体是 ;
(2)含有极性键的分子晶体是 ;
(3)只含离子键的离子晶体是 ;
(4)含有极性共价键的原子晶体是 ;
(5)既含有离子键,又含有极性共价键和配位键的离子晶体是 。
查看答案和解析>>
科目: 来源:2016-2017学年宁夏银川市高二下学期第一次月考化学试卷(解析版) 题型:填空题
请认真审题并作答:
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:_______________________。CaCN2中阴离子为CN22-,与CN22-互为等电子体的分子有N2O和CO2,由此可以推知CN22-的空间构型为__________________。
(2)三聚氰胺(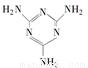 )俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸(
)俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸( )后,三聚氰酸与三聚氰胺分子相互之间通过______________结合。在肾脏内易形成结石。
)后,三聚氰酸与三聚氰胺分子相互之间通过______________结合。在肾脏内易形成结石。
(3)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为_________。

(4)CaO晶体和NaCl晶体的晶格能分别为:CaO 3401kJ·mol-1、NaCl 786kJ·mol-1。导致两者晶格能差异的主要原因是________________。
查看答案和解析>>
科目: 来源:2016-2017学年宁夏银川市高二下学期第一次月考化学试卷(解析版) 题型:填空题
锌是一种过渡金属,锌及其化合物有着广泛的应用。
(1)指出锌在周期表中的位置:第________周期,第________族,________区。
(2)葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂。写出Zn2+基态电子排布式__________________;葡萄糖分子中碳原子的杂化方式为______________。
(3)Zn2+能与NH3形成配离子[Zn(NH3)4]2+。配位体NH3分子属于________________(填“极性分子”或“非极性分子”);在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,NH3位于正四面体的顶点,则[Zn(NH3)4]2+中中心离子的杂化轨道类型是_____________。

(4)上图表示锌与某非金属元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为___________________;该化合物晶体的熔点比干冰高得多,原因是______________________________________________。
(5)与锌同周期,最外层有3个未成对电子的元素名称是________________,该元素最高价氧化物对应水化物的酸性比溴的最高价氧化物对应水化物的酸性___________(填“强”或“弱”)。
查看答案和解析>>
科目: 来源:2016-2017学年宁夏银川市高二下学期第一次月考化学试卷(解析版) 题型:填空题
氧是地壳中含量最多的元素。
(1)氧元素基态原子核外未成对电子数为___________个。
(2)H2O分子内的O—H键、分子间的范德华力和氢键从强到弱依次为_______________。
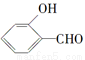 的沸点比
的沸点比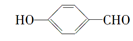 高,原因是______________________。
高,原因是______________________。
(3)H+可与H2O形成H3O+,H3O+中O原子采用________杂化。H3O+中H—O—H键角比H2O中H—O—H键角大,原因为________________。
(4)CaF2离子晶体的晶胞结构如图所示。该离子化合物晶胞的边长为a cm,则晶体的密度是_____________g/cm3(只要求列出算式)。
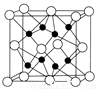
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com