
科目: 来源: 题型:
【题目】中国的稀土资源十分丰富,有开采价值的储量居世界第一。某实验小组拟利用含铝、硅、铁等杂质的氟碳钵矿(主要成分为CeFCO3)制备三氯化铈,设计如图所示流程:
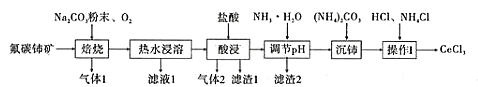
已知:①Ce2O3在加热条件下能被氧气氧化,生成难溶于水、具有强氧化性的CeO2。
②M(CeCl3)=246.5g/mol,在水溶液中Ce4+能被还原成Ce3+。
③0.1mol·L-1金属阳离子形成氢氧化物沉淀的pH如下:
金属阳离子 | Fe3+ | Ce3+ | Al3+ |
开始沉淀的pH | 1.5 | 7.6 | 3.4 |
沉淀完全的pH | 2.8 | 9.4 | 4.7 |
回答下列问题:
(1)氟碳铈矿中铈的化合价为______,滤渣1的化学式为__________。
(2)焙烧氟碳铈矿生成CeO3的化学方程式是____________。
(3)酸浸时产生气体2的离子反应方程式是_______。
(4)为将铝、铁以滤渣2除去,用NH3·H2O调节酸浸后溶液的pH最大不能超过______。
(5)将沉铈得到的Ce2(CO3)3·nH2O洗涤干净后继续进行操作I,简述如何证明Ce2(CO3)3·nH2O已经洗涤干净________。
(6)操作I是将得到的Ce2(CO3)3·nH2O加盐酸至沉淀完全溶解,先经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到CeCl3·7H2O,再将该晶体与NH4Cl固体隔绝空气共热,得到无水CeCl3。其中,NH4Cl的作用是___________。
(7)产品纯度测定:准确称取CeCl3产品0.3750g于锥形瓶中,加入合适的氧化剂将Ce3+恰好完全氧化为Ce4+,再用0.1000mol/L的(NH4)2Fe(SO4)2 标准溶液滴定至终点,重复3次实验,标准液的消耗体积分别为12.48mL、12.50mL、12.52mL。求该样品的质量分数为_______(保留1位小数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇(CH3OH)热值高、无污染,既可做燃料,又是重要的化工原料。科学家正研究利用CO2生产甲醇以发展低碳经济。
(1)已知CO(g)和CH3OH(l)的燃烧热分别为283kJmol-1和726kJmol-1。则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为______。
(2)根据甲醇在酸性电解质溶液中与氧气作用生成二氧化碳和水的反应,设计一种燃料电池,则其负极反应式为______。若该燃料电池消耗1mol甲醇所能产生的最大电能为689.7kJ,与其燃烧所能释放的全部能量相比,该燃料电池的理论效率为______。
(3)探究不同条件下对合成甲醇反应的影响:CO2(g)+3H2(g)CH3OH(g)+H2O(g)。
①其他条件不变,T1、T2两种温度下CH3OH的物质的量随时间的变化如图,则该反应在T1时的平衡常数比T2时的______(填“大”、“小”),处于A点的反应体系从T1变到T2,达到平衡时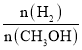 ______(填“增大”、“减小”或“不变”)。
______(填“增大”、“减小”或“不变”)。
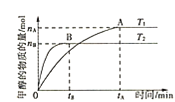
②某温度下,在体积为1L的密闭容器中加入4molCO2、8molH2,测得H2的物质的量随时间变化如图曲线(甲)所示:

则a→b时间段内v(CH3OH)=______molL-1min-1;若仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线(乙)所示。曲线(乙)对应改变的实验条件可以是______(填序号)。
A.加催化剂 B.增大压强 C.升高温度 D.增大CO2浓度
若图中曲线甲平衡后保持恒温恒容,按如表各组的物质的量再次增加投入反应混合物,其中平衡向正反应方向进行的是______。
物质 | n(CO2) | n(H2) | n(CH3OH) | n(H2O) |
A | 0 | 0 | 1 | 1 |
B | 1 | 0 | 1 | 0 |
C | 0 | 1 | 1 | 0 |
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,用0.10molL-1的氨水滴定10.00mL0.05molL-1的二元酸H2A的溶液,滴定过程中加入氨水的体积(V)与溶液中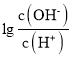 的关系如图所示。下列说法正确的是( )
的关系如图所示。下列说法正确的是( )
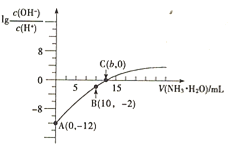
A.H2A的电离方程式为H2AH++HA-
B.B点溶液中,水电离出的氢离子浓度为1.0×10-6molL-1
C.C点溶液中,c(NH4+)+c(NH3H2O)=2c(A2-)
D.25℃时,氨水的电离平衡常数为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】药物中间体F的一种合成路线如图:
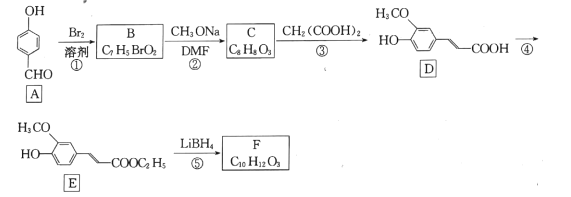
已知:RCOOR′![]() RCH2OH+R′OH(R为H或烃基,R'为烃基)
RCH2OH+R′OH(R为H或烃基,R'为烃基)
回答下列问题;
(1)A中官能团名称是 __________。
(2)反应①的反应类型是 ____。
(3)反应②的化学方程式为 ___________。
(4)反应④所需的试剂和条件是______________。
(5)F的结构简式为____。
(6)芳香化合物W是E的同分异构体,W能水解生成X、Y两种化合物,X、Y的核磁共振氢谱均有3组峰,X的峰面积比为3:2:1,Y的峰面积为1:1:1,写出符合题意的W的结构简式 ___(写一种)。
(7)肉桂酸![]() 广泛用于香料工业与医药工业,设计以苯甲酸甲酯和丙二酸为起始原料制备肉桂酸的合成路线:_______________(无机试剂任用)。
广泛用于香料工业与医药工业,设计以苯甲酸甲酯和丙二酸为起始原料制备肉桂酸的合成路线:_______________(无机试剂任用)。
查看答案和解析>>
科目: 来源: 题型:
【题目】乙烯气相直接水合反应制备乙醇:C2H4(g)+H2O(g) ![]() C2H5OH(g)。乙烯的平衡转化率随温度、压强的变化关系如下(起始时,n(H2O)=n(C2H4)=1 mol,容器体积为1 L)。下列分析不正确的是( )
C2H5OH(g)。乙烯的平衡转化率随温度、压强的变化关系如下(起始时,n(H2O)=n(C2H4)=1 mol,容器体积为1 L)。下列分析不正确的是( )
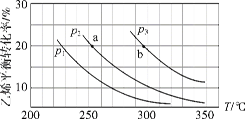
A.乙烯气相直接水合反应的H<0
B.图中压强的大小关系为:p1>p2>p3
C.图中a点对应的平衡常数K =![]()
D.达到平衡状态a、b所需要的时间:a>b
查看答案和解析>>
科目: 来源: 题型:
【题目】某化合物与Cu+结合形成如图所示的离子,则下列说法错误的是( )
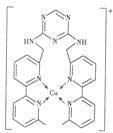
A.Cu+的核外电子排布式为[Ar]3d9
B.该离子中含有极性键、非极性键和配位键
C.该离子中碳原子的杂化方式有sp2、sp3两种
D.该离子中无手性碳原子
查看答案和解析>>
科目: 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,是一种淡黄色粉末,易溶于水,不溶于乙醇。在实验室制备连二亚硫酸钠流程如下:
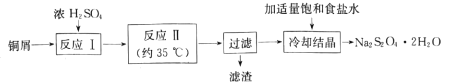
(1)反应Ⅰ是制备SO2,下图装置可制取纯净干燥的SO2:
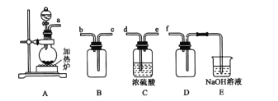
①按气流方向连接各仪器接口,顺序为a→ ___→f,装置D的作用是______。
②装置A中反应的化学方程式为___。
(2)反应Ⅱ所用实验装置如图所示(部分装置省略)。
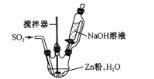
①通SO2之前先强力搅拌,将锌粉和水制成悬浊液,其目的是_________;控制反应温度的方法是____
②反应Ⅱ的离子方程式为 ___。
(3)“滤渣”经洗涤、灼烧,可得到一种工业产品是____(填化学式);加入适量饱和食盐水的目的是 ___。
(4)产品Na2S2O42H2O久置空气中易被氧化,其氧化产物可能是_______(写2种)。
查看答案和解析>>
科目: 来源: 题型:
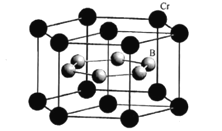
【题目】铬、硼的合金及其化合物用途非常广泛。回答下列问题:
(1)基态Cr原子核外电子的排布式是[Ar] ___;基态硼原子中占据最高能级的电子云轮廓图为____形。
(2)铬的配合物有氯化三乙二胺合铬![]() 和三草酸合铬酸铵{(NH4)3[Cr(C2O4)3]}等。
和三草酸合铬酸铵{(NH4)3[Cr(C2O4)3]}等。
①配体en表示NH2CH2CH2NH2,其中碳原子的杂化方式是____。
②NH4+空间构型为____,与其键合方式相同且空间构型也相同的含硼阴离子是_____ 。
③C、N、O三种元素第一电离能由小到大的顺序为 ___;![]() 含有三个五元环,画出其结构:_______________。
含有三个五元环,画出其结构:_______________。
(3)硼酸[H3BO3或B(OH)3]为白色片状晶体,熔点为171℃。下列说法正确的是___填字母)。
A.硼酸分子中,∠OBO的键角为120° B.硼酸分子中存在σ键和π键
C.硼酸晶体中,片层内存在氢键 D.硼酸晶体中,片层间存在共价键
(4)2019年11月《EurekAlert》报道了铬基氮化物超导体,其晶胞结构如图所示:
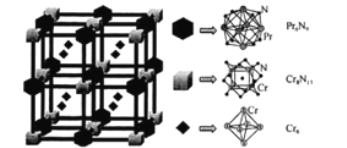
由三种元素Pr(镨)、Cr、N构成的该化合物的化学式为 ___。
(5)CrB2的晶胞结构如图所示,六棱柱底边边长为acm,高为c cm,阿伏加德罗常数的值为NA,CrB2的密度为 ___gcm-3(列出计算式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是元素周期表的一部分,所列字母分别代表一种化学元素。下列说法正确的是( )
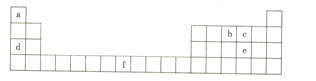
A.b的第一电离能小于c的第一电离能
B.d在c的常见单质中燃烧,产物中既含有离子键也含有共价键
C.e与a组成的化合物沸点比水低,原因是水分子之间可形成氢键
D.f元素的基态原子失去4s能级上的所有电子后所形成的离子最稳定
查看答案和解析>>
科目: 来源: 题型:
【题目】甲烷催化裂解、氧气部分氧化和水煤气重整是目前制氢的常用方法。回答下列问题:
(1)甲烷隔绝空气分解,部分反应如下:
Ⅰ.CH4(g)=C(s)+2H2(g) H1=+74.9kJ/mol
Ⅱ.6CH4(g)=C6H6(g)+9H2(g) H2=+531kJ/mol
Ⅲ.2CH4(g)=C2H4(g)+2H2(g) H3=+202kJ/mol
①反应I的△S___(填“>”或“<”)0。
②![]() 的 △H=______kJ/mol。
的 △H=______kJ/mol。
(2)CH4用水蒸气重整制氢包含的反应为:
Ⅰ.水蒸气重整:![]()
Ⅱ.水煤气变换:![]()
平衡时各物质的物质的量分数如图所示:
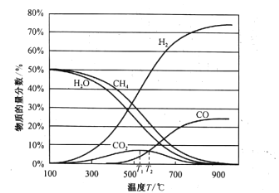
①为提高CH4的平衡转化率,除压强、温度外,还可采取的措施是___________(写一条)。
②温度高于T1℃时,CO2的物质的量分数开始减小,其原因是___________。
③T2℃时,容器中![]() ______________。
______________。
(3)甲烷部分氧化反应为![]() 。已知甲烷部分氧化、甲烷水蒸气重整、水煤气变换反应的平衡常数的自然对数lnKp与温度的关系如图所示:
。已知甲烷部分氧化、甲烷水蒸气重整、水煤气变换反应的平衡常数的自然对数lnKp与温度的关系如图所示:
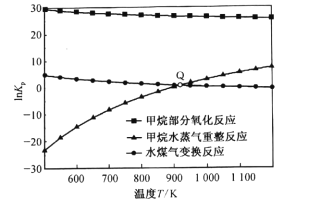
①图中Q点时,反应![]() 的InKp=________。
的InKp=________。
②在某恒压密闭容器中充入lmol CH4和1mol H2O(g)在某温度下发生水蒸气重整反应达到平衡时,CH4的转化率为50%,容器总压强为1 atm。H2的平衡分压p(H2)=____atm;此温度下反应的lnKp=___(已知;ln3≈l.1,ln4≈l.4)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com