
【题目】甲烷催化裂解、氧气部分氧化和水煤气重整是目前制氢的常用方法。回答下列问题:
(1)甲烷隔绝空气分解,部分反应如下:
Ⅰ.CH4(g)=C(s)+2H2(g) H1=+74.9kJ/mol
Ⅱ.6CH4(g)=C6H6(g)+9H2(g) H2=+531kJ/mol
Ⅲ.2CH4(g)=C2H4(g)+2H2(g) H3=+202kJ/mol
①反应I的△S___(填“>”或“<”)0。
②![]() 的 △H=______kJ/mol。
的 △H=______kJ/mol。
(2)CH4用水蒸气重整制氢包含的反应为:
Ⅰ.水蒸气重整:![]()
Ⅱ.水煤气变换:![]()
平衡时各物质的物质的量分数如图所示:
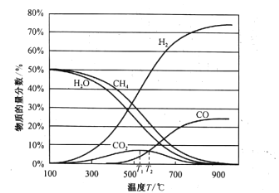
①为提高CH4的平衡转化率,除压强、温度外,还可采取的措施是___________(写一条)。
②温度高于T1℃时,CO2的物质的量分数开始减小,其原因是___________。
③T2℃时,容器中![]() ______________。
______________。
(3)甲烷部分氧化反应为![]() 。已知甲烷部分氧化、甲烷水蒸气重整、水煤气变换反应的平衡常数的自然对数lnKp与温度的关系如图所示:
。已知甲烷部分氧化、甲烷水蒸气重整、水煤气变换反应的平衡常数的自然对数lnKp与温度的关系如图所示:
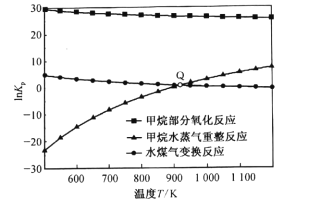
①图中Q点时,反应![]() 的InKp=________。
的InKp=________。
②在某恒压密闭容器中充入lmol CH4和1mol H2O(g)在某温度下发生水蒸气重整反应达到平衡时,CH4的转化率为50%,容器总压强为1 atm。H2的平衡分压p(H2)=____atm;此温度下反应的lnKp=___(已知;ln3≈l.1,ln4≈l.4)。
【答案】> +75 增大起始时![]() (或及时从产物中分离出氢气) 反应Ⅱ为放热反应,从T1℃升高温度,平衡向逆反应方向移动的因素大于CO浓度增大向正反应方向移动的因素,净结果是平衡逆向移动 7(或7:1) 0 0.5 -0.3
(或及时从产物中分离出氢气) 反应Ⅱ为放热反应,从T1℃升高温度,平衡向逆反应方向移动的因素大于CO浓度增大向正反应方向移动的因素,净结果是平衡逆向移动 7(或7:1) 0 0.5 -0.3
【解析】
(1)①气体体积增大的过程为熵增的过程,熵增过程△S大于0,反之小于0,反应I为CH4(g)=C(s)+2H2(g),气体物质的量增大,混乱度增大,属于熵增的过程,△S>0;
②已知:Ⅱ.6CH4(g)=C6H6(g)+9H2(g) H2=+531kJ/mol
Ⅲ.2CH4(g)=C2H4(g)+2H2(g) H3=+202kJ/mol
根据盖斯定律,Ⅲ×3-Ⅱ可得:C6H6(g)+3H2(g)=3C2H4(g) △H=(+202kJ/mol)×3-(+531kJ/mol)=+75 kJ/mol;
(2)①为提高CH4的平衡转化率,即要让反应向正向进行,除压强、温度外,还可将生成的氢气从产物中分离出去,或增大起始时的![]() ;
;
②反应Ⅰ是吸热反应,升高温度,平衡正向移动,CO的浓度增大,反应Ⅱ为放热反应,升高温度,反应逆向进行,CO2的量减少,出现如图所示CO2的物质的量分数开始减小,说明T1℃升高温度,平衡向逆向移动的因素大于CO浓度增大向正向移动的因素,结果是平衡逆向移动;
③根据图像,T2℃时,容器中一氧化碳和二氧化碳的物质的量分数相等,设T2℃时,二氧化碳的物质的量为x,列三段式:
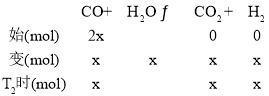
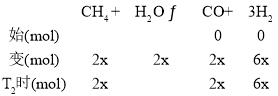
根据上述分析,T2℃时,n(H2)=6x+x=7x,n(CO2)=x,则![]()
![]() =7;
=7;
(3)①图中Q点时,甲烷水蒸气重整、水煤气变换反应的平衡常数的自然对数lnKp相等,即压强平衡常数相等,则 ,可得
,可得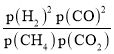 =1;则反应
=1;则反应![]() 的压强平衡常数Kp=
的压强平衡常数Kp=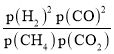 =1,则lnKp=ln1=0;
=1,则lnKp=ln1=0;
②在某恒压密闭容器中充入lmol CH4和1mol H2O(g)在某温度下发生水蒸气重整反应达到平衡时,CH4的转化率为50%,容器总压强为1atm。根据反应![]() ,则平衡时n(CH4)=lmol-lmol×50%=0.5mol,n(H2O)= lmol -lmol×50%=0.5mol,n(CO)=0.5mol,n(H2)=3×0.5mol=
,则平衡时n(CH4)=lmol-lmol×50%=0.5mol,n(H2O)= lmol -lmol×50%=0.5mol,n(CO)=0.5mol,n(H2)=3×0.5mol=![]() ×1atm=0.5 atm,用压强表示该反应的平衡常数Kp=
×1atm=0.5 atm,用压强表示该反应的平衡常数Kp=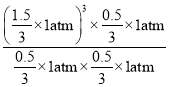 =
=![]() ,则lnKp=ln
,则lnKp=ln![]() = ln3- ln4=1.1-1.4=-0.3。
= ln3- ln4=1.1-1.4=-0.3。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】磷酸铝(AlPO4)是一种用途广泛的材料,在建筑、耐火材料、化工等方面具有广泛的应用前景。以磷硅渣(主要成分为Ca3(PO4)2、Al2O3、SiO2和V2O5等)为原料制备磷酸铝的工艺流程如图所示:
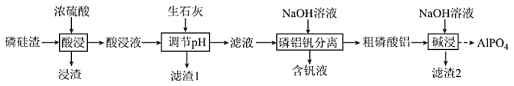
回答下列问题:
(1)酸浸液中含磷元素的主要粒子是_____(填化学式,下同),浸渣中的主要化学成分是_____。
(2)生石灰除了调节pH外,另一作用是_____。
(3)滤液中钒元素以V3O93-形式存在,V3O93-易水解为[VO3(OH)]2-,该水解反应的离子方程式为_____。
(4)碱浸时,粗磷酸铝转化为可溶性溶质,则可溶性溶质分别是_____ (填化学式)。
(5)实验测得pH、反应温度与时间对碱浸时固相中P、Al含量的影响如图所示:

则最优反应条件是_____。
(6)固相反应制备磷酸铝的方法之一是在900℃的焙烧炉内加热磷酸二氢铵与氧化铝混合物,写出该反应的化学方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原滴定原理同中和滴定原理相似,为了测定某未知浓度的NaHSO3溶液的浓度,现用0.2000mol/L的酸性KMnO4溶液进行滴定,回答下列问题:
(1) 配平离子方程式:______MnO4-+HSO3-+H+=Mn2++SO42-+H2O。
(2)用KMnO4进行滴定时,KMnO4溶液应装在_______________中,判断滴定终点的现象是_______。
(3)下列操作会导致测定结果偏高的是_________。
A. 盛装未知浓液的锥形瓶用蒸馏水洗过,未用待测液润洗
B. 未用标准浓度的酸性KMnO4溶液润洗滴定管
C. 观察读数时,滴定前仰视,滴定后俯视
D. 滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
(4) 根据下表测定的实验数据,计算KMnO4溶液体积的平均值为___mL;NaHSO3溶液的物质的量浓度为___mol/L(数据精确到0.1)。
试验编号 | 待测NaHSO3溶液的体积/ mL | KMnO4溶液体积/ mL |
1 | 20.00 | 15.98 |
2 | 20.00 | 17.00 |
3 | 20.00 | 16.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研人员提出HCHO与O2在羟基磷灰石(HAP)表面催化氧化生成CO2、H2O的历程,该历程示意图如下(图中只画出了HAP的部分结构)。下列说法不正确的是
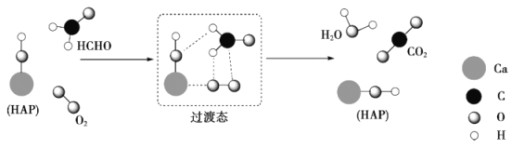
A.HAP能提高HCHO与O2的反应速率
B.根据图示信息,CO2分子中的氧原子全部来自O2
C.HCHO在反应过程中,有C-H键发生断裂
D.该反应可表示为: HCHO+O2![]() CO2+H2O
CO2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.10 mol/L的NaOH溶液分别滴定体积均为20.00mL、浓度均为0.050 mol/L的盐酸、磷酸及谷氨酸(H2G),滴定曲线如图所示:
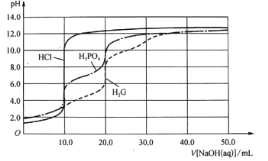
下列说法正确的是
A.滴定盐酸时,用甲基橙作指示剂比用酚酞更好
B.H3PO4与H2G的第一电离平衡常数K1的数量级不同
C.用酚酞作指示剂滴定磷酸到终点时,溶液中的溶质为Na2HPO4
D.NaH2PO4溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯气相直接水合反应制备乙醇:C2H4(g)+H2O(g) ![]() C2H5OH(g)。乙烯的平衡转化率随温度、压强的变化关系如下(起始时,n(H2O)=n(C2H4)=1 mol,容器体积为1 L)。下列分析不正确的是( )
C2H5OH(g)。乙烯的平衡转化率随温度、压强的变化关系如下(起始时,n(H2O)=n(C2H4)=1 mol,容器体积为1 L)。下列分析不正确的是( )
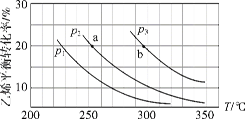
A.乙烯气相直接水合反应的H<0
B.图中压强的大小关系为:p1>p2>p3
C.图中a点对应的平衡常数K =![]()
D.达到平衡状态a、b所需要的时间:a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验设计不合理的是
A. 自制“84”消毒液
自制“84”消毒液
B.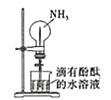 利用喷泉实验探究NH3的部分性质
利用喷泉实验探究NH3的部分性质
C.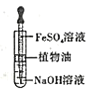 制备Fe(OH)2白色沉淀
制备Fe(OH)2白色沉淀
D.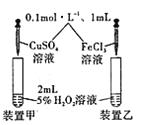 探究不同催化剂对双氧水分解速率的影响
探究不同催化剂对双氧水分解速率的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚烷是一种重要的化工原料,工业上可通过下列途径制备:
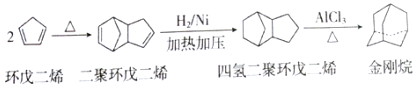
请回答下列问题:
(1)环戊二烯分子中最多有__个原子共平面。
(2)金刚烷的分子式为__,其二氯代物有_种。
(3)已知烯烃能发生如下反应:
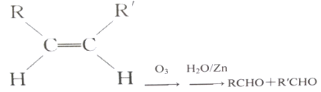 。
。
请写出下列反应产物的结构简式:![]()
![]() __。
__。
(4)A是二聚环戊二烯的同分异构体,能使溴的四氯化碳溶液褪色,A经高锰酸钾酸性溶液加热氧化可以得到对苯二甲酸提示:苯环上的烷基(—CH3,—CH2R,—CHR2)或烯基侧链经高锰酸钾酸性溶液氧化得羧基,写出A所有可能的结构简式不考虑立体异构:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述与示意图一致的是
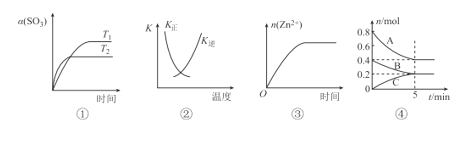
A.图①表示2SO3(g)=2SO2(g)+O2(g) △H>0,SO3的平衡转化率随温度、时间的变化
B.图②中曲线表示反应H2(g)+I2(g)=2HI(g) △H<0正、逆反应的平衡常数K随温度的变化
C.图③表示20 mL 0.1 mol/L稀盐酸与过量锌粒混合时,n(Zn2+)随时间的变化
D.图④反应从开始到平衡的平均反应速率v(B)=0.04molL-1min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com