
科目: 来源: 题型:
【题目】常温下,几种弱电解质的pK(pK=-lgK)如下表所示:
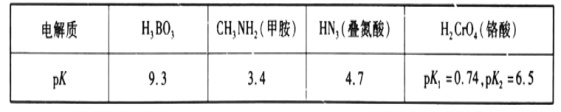
请回答下列问题:
(1)硼酸(H3BO3)在水中存在电离平衡:H3BO3+H2O![]() B(OH)4-+H+。由此推断,硼酸是___(填字母)。
B(OH)4-+H+。由此推断,硼酸是___(填字母)。
A.一元酸 B.三元酸 C.强酸 D.弱酸
(2)常温下,在H3BO3、HN3、H2CrO4中酸性最强的是___(填化学式)。
(3)H2CrO4的二级电离常数表达式Ka2=___。
(4)甲胺在水中的电离和NH3类似,写出CH3NH2在水中的电离方程式:___。
(5)常温下,20mLpH=2的HN3溶液与xmLpH=12的NaOH溶液恰好完全反应,则x___(填“>”“<”或“=”)20mL。
查看答案和解析>>
科目: 来源: 题型:
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3,还含有少量FeS2)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下,下列叙述不正确的是

A. 加入CaO可以减少SO2的排放同时生成建筑材料CaSO4
B. 向滤液中通入过量CO2、过滤、洗涤、灼烧沉淀可制得Al2O3
C. 隔绝空气焙烧时理论上反应消耗的n(FeS2)∶n(Fe2O3)=1∶5
D. 烧渣分离可以选择用磁铁将烧渣中的Fe3O4分离出来
查看答案和解析>>
科目: 来源: 题型:
【题目】依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。
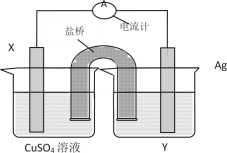
请回答下列问题:
(1)电解质溶液Y是__;
(2)X电极上发生的电极反应为__。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒。当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流。试回答下列问题:
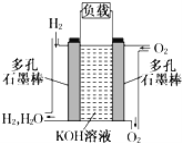
(1)图中通过负载的电子流动方向__(填“向左”或“向右”)。
(2)写出氢氧燃料电池工作时正极电极反应方程式。__。
(3)若将此燃料电池改进为直接以甲烷和氧气为原料进行工作时,负极电极反应方程式为__。
查看答案和解析>>
科目: 来源: 题型:
【题目】SiH4是一种无色的气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O,已知室温下2gSiH4自燃放出热量89.2kJ,其热化学方程式为:__。
查看答案和解析>>
科目: 来源: 题型:
【题目】氨气是极易溶于水的气体,常温常压下,1体积水大约能溶解700体积的氨气。
(1)实验室可在浓氨水中加入固体NaOH快速制取氨气,请用化学平衡移动原理简述原因___。
(2)甲、乙两瓶氨水的浓度分别为1mol·L-1和0.1mol·L-1,则甲、乙两瓶氨水中c(OH-)之比___(填“>”、“<”或“=”)10。
(3)向10mL0.1mol/L的氨水中逐滴加入20mL0.1mol/L的醋酸,溶液导电性的变化是___。写出二者反应的离子方程式:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是__。
A.KMnO4 B.H2O2 C.Cl2水 D.HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的__。
A.NaOH B.NH3·H2O C.CuO D.Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,已知Ksp(AmBn)=[c(An+)]m.[c(Bm-)]n,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为__,Fe3+完全沉淀时溶液的pH为__,通过计算确定上述方案__(填“可行”或“不可行”)。(提示:lg2=0.3)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
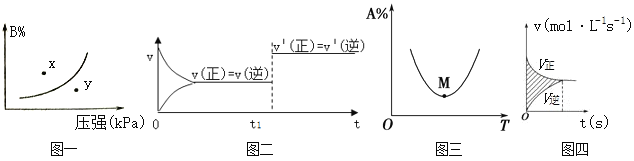
A. 图一表示反应:mA(s)+nB(g)pC(g) △H>O,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,反应速率x点比y点时的慢.
B. 图二是可逆反应:A(g)+B(s)C(s)+D(g) △H>O的速率时间图像,在t1时刻改变条件一定是加入催化剂。
C. 图三表示对于化学反应mA(g)+nB(g) pC(g)+qD(g),A的百分含量与温度(T)的变化情况,则该反应的ΔH>0。
D. 图四所示图中的阴影部分面积的含义是(v正-v逆)
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭容器中一定量混合气体发生反应:2 A(g)+2B(g)![]() xC(g),达到平衡时测得A的浓度为0.5mol/L,在温度不变的条件下,将容器中的容积扩大到原来2倍,再达平衡时,测得A的浓度为0.3mol/L,下列有关判断正确的是( )
xC(g),达到平衡时测得A的浓度为0.5mol/L,在温度不变的条件下,将容器中的容积扩大到原来2倍,再达平衡时,测得A的浓度为0.3mol/L,下列有关判断正确的是( )
A.x=4B.平衡向正反应方向移动
C.B的转化率降低D.C的体积分数增大
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,将 0.10 mol·L-1 盐酸滴入 20.00 mL 0.10 mol·L-1 氨水中,溶液中 pH 和 pOH 随加入盐酸体积变化曲线如图所示。已知:pOH=—lgc(OH),下列正确的是
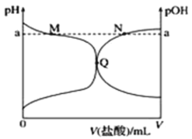
A.M 点所示溶液中可能存在:c(Cl)>c(NH4+)
B.M 点到Q点所示溶液中水的电离程度先变大后减小
C.Q 点盐酸与氨水恰好中和
D.N 点所示溶液中可能存在:c(NH4+)+c(NH3·H2O)=c(Cl)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com