
科目: 来源: 题型:
【题目】常温下,0.1mol/LH2C2O4水溶液中存在H2C2O4、HC2O4-和C2O42-三种形态含碳粒子,用NaOH或HCl调节该溶液的pH,三种含碳粒子的分布系数δ随溶液pH变化的关系如图[已知:a=1.35,b=4.17,Ksp(CaC2O4)=2.3×10-9,忽略溶液体积变化]。下列说法正确的是( )

A.pH=5时,溶液中主要含碳物种浓度大小关系为:c(C2O42-)>c(H2C2O4)>c(HC2O4-)
B.已知pKa=-lgKa,则pKa2(H2C2O4)=4.17
C.0.1mol·L-1NaHC2O4溶液中:c(H+)=c(OH-)+c(C2O42-)-c(H2C2O4)
D.一定温度下往CaC2O4饱和溶液中加入少量CaCl2固体,c(C2O42-)将减小,c(Ca2+)不变
查看答案和解析>>
科目: 来源: 题型:
【题目】向某容积为2L的恒容密闭容器中充入2molX(g)和1molY(g),发生反应2X(g)+Y(g)![]() 3Z(g)。反应过程中,持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( )
3Z(g)。反应过程中,持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( )

A.M点时,Y的转化率最大
B.平衡后充入X,达到新平衡时X的体积分数减小
C.升高温度,平衡常数减小
D.W、M两点Y的正反应速率相同
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关电化学原理的说法正确的是
A.用惰性电极电解MgCl2饱和溶液可制得金属镁
B.用惰性电极电解CuCl2溶液时,阳极表面生成红色物质
C.在铁钉表面电镀铜时,将铁钉作阳极,铜作阴极,硫酸铜溶液为电解质
D.用石墨电极电解饱和食盐水的过程中,溶液的pH逐渐增大
查看答案和解析>>
科目: 来源: 题型:
【题目】设阿伏加德罗常数的值为NA,下列说法正确的是
A.25°C时,pH=13的氢氧化钡溶液中含有OH-0.1NA个
B.电解精炼铜时,当电路中转移NA个电子,阳极的质量一定减轻了32g
C.0.1 mol H2和0.1 mol I2于密闭容器中充分反应后,其分子总数为0.2NA
D.1 L 0.1 mol·L-1 NH4Cl溶液中,NH4+的数量为0.1NA
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上利用粗ZnO(含FeO、CuO)制取金属锌的流程如下(部分步骤省略):

已知:几种离子形成氢氧化物沉淀时的pH如下表:
待沉淀的离子 | Fe2+ | Fe3+ | Zn2+ | Cu2+ |
开始沉淀时pH | 6.3 | 1.5 | 6.2 | 5.2 |
沉淀完全时pH | 9.7 | 3.2 | 8.0 | 6.4 |
请回答下列问题:
(1)酸浸粗氧化锌的过程中,常将粗氧化锌粉碎成细颗粒,适当增加硫酸的浓度,目的是_________。
(2)步骤A的目的是将Fe2+氧化为Fe3+,并全部形成Fe(OH)3沉淀,为了暂不形成Cu(OH)2 Zn(OH)2 ,该步骤需控制溶液pH的范围是____________,该步骤中先加入H2O2充分反应后再加入氨水,写出加入H2O2的离子方程式_____________。
(3)步骤C的反应离子方程式为____________。
(4)若步骤A中加入H2O2后,室温下将溶液的pH调为4,求Fe3+ 离子浓度为_________。(已知Ksp[Fe(OH)3]= 4.0×10-3 8)
查看答案和解析>>
科目: 来源: 题型:
【题目】Li—SOCl2电池是迄今具有最高能量比的电池。该电池的电极材料分别为锂和碳,电解液(熔点-110℃、沸点78.8℃)是LiAlCl4—SOCl2。电池的总反应可表示为:4Li+2SOCl2=4LiCl+S+SO2。下列说法正确的是( )
A.该电池不能在寒冷地区正常工作
B.SOCl2分子的空间构型是平面三角形
C.该电池工作时,正极反应为:2SOCl2+4e-=4Cl-+S+SO2
D.该电池组装时,必须在无水无氧条件下进行
查看答案和解析>>
科目: 来源: 题型:
【题目】有机化学反应因反应条件不同,可生成不同的有机产品。例如:
 (X为卤素原子)
(X为卤素原子)
苯的同系物与卤素单质混合,若在光照条件下,则苯环侧链上的氢原子被卤素原子取代;若在催化剂作用下,则苯环上的氢原子被卤素原子取代。工业上利用上述信息,按下列路线合成一种香料:
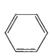
![]() A
A![]() B(一氯代物)
B(一氯代物)![]() C
C![]() D
D![]() E
E ![]()
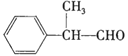 (香料)
(香料)
已知A的核磁共振氢谱上有5组峰,且峰面积之比为![]() 。请回答下列问题。
。请回答下列问题。
(1)A的结构简式为____________,E的结构简式为_____________。
(2)反应①的反应类型为_______,物质C中的官能团名称是________。
(3)反应③的反应条件是_______。
(4)反应④的化学方程式为_________(注明反应条件)。
(5)这种香料具有多种同分异构体,写出符合下列条件的同分异构体可能的结构简式:___________。
①含有酚羟基 ②分子中有苯环,且苯环上的一溴代物有两种 ③在一定条件下,自身能形成高聚物
查看答案和解析>>
科目: 来源: 题型:
【题目】A~G都是有机化合物,它们的转化关系如下:
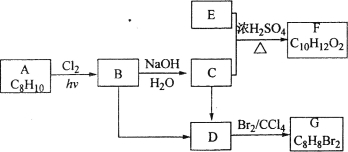
请回答下列问题:
(1)已知:6.0 g化合物E完全燃烧生成8.8 g CO2和3.6 g H2O;E的蒸气对氢气的相对密度为30,则E的分子式为_______________。
(2)A为一取代芳烃,B中含有一个甲基。由B生成C的化学方程式为 。
(3)由B生成D、由C生成D的反应条件分别是_______________、_______________。
(4)由A生成B、由D生成G的反应类型分别是_______________、_______________。
(5)F存在于栀子香油中,其结构简式为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】高纯碳酸锰在电子工业中有重要的应用,湿法浸出软锰矿(主要成分为MnO2,含少量Fe、Al、Mg等杂质元素)制备高纯碳酸锰的实验过程如下:其中除杂过程包括:①向浸出液中加入一定量的X,调节浸出液的pH为3.5~5.5;②再加入一定量的软锰矿和双氧水,过滤;③…下列说法正确的是( )
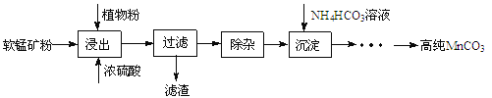
A.试剂X可以是MnO、MnO2、MnCO3等物质
B.浸出时加入植物粉的作用是作为还原剂
C.除杂过程中调节浸出液的pH为3.5~5.5可完全除去Fe、Al、Mg等杂质
D.为提高沉淀MnCO3步骤的速率可以持续升高温度
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验中,能达到相应实验目的的是
|
|
|
|
A.制备并收集乙酸乙酯 | B.证明氯化银溶解度大于硫化银 | C.验证溴乙烷的消去产物是乙烯 | D.推断S、C、Si的非金属性强弱 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com