
科目: 来源: 题型:
【题目】孔雀石的主要成分是Cu2(OH)2CO3(含Fe2O3、FeCO3、Al2O3、SiO2杂质),工业上用孔雀石制备硫酸铜的第一步需用过量的硫酸溶解并过滤常温下,分别取滤液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是
A.加入过量氨水:Fe3+、![]() 、
、![]() 、OH-
、OH-
B.加入过量NaOH溶液:Na+、[Al(OH)4]-、![]() 、OH-
、OH-
C.加入过量H2O2溶液:Fe2+、H+、![]() 、Cu2+
、Cu2+
D.加入过量 NaHCO3溶液:Na+、Al3+、![]() 、
、![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:![]() (橙色)+H2O2
(橙色)+H2O2![]() (黄色)+2H+,用K2Cr2O7溶液进行下列实验:
(黄色)+2H+,用K2Cr2O7溶液进行下列实验:
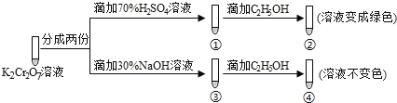
下列说法正确的是
A.①中溶液变黄,③中溶液橙色加深
B.②中![]() 被C2H5OH氧化
被C2H5OH氧化
C.若向④中加入70%H2SO4溶液至过量,溶液变为绿色
D.K2Cr2O7在碱性条件下的氧化性比酸性条件更强
查看答案和解析>>
科目: 来源: 题型:
【题目】298 K时,![]() γ-羟基丁酸水溶液发生如下反应,生成
γ-羟基丁酸水溶液发生如下反应,生成![]() 丁内酯: HOCH2CH2CH2COOH
丁内酯: HOCH2CH2CH2COOH![]()
![]() +H2O
+H2O
不同时刻测得![]() 丁内酯的浓度如下表。
丁内酯的浓度如下表。
| 20 | 50 | 80 | 100 | 120 | 160 | 220 | ∞ |
| 0.024 | 0.050 | 0.071 | 0.081 | 0.090 | 0.104 | 0.116 | 0.132 |
注:该条件下副反应、溶液体积变化忽略不计。下列分析正确的是
A.增大γ-羟基丁酸的浓度可提高γ-丁内酯的产率
B.298 K时,该反应的平衡常数为2.75
C.反应至120 min时,γ-羟基丁酸的转化率<50%
D.80~120 min的平均反应速率:v(γ-丁内酯) >1.2×10-3 mol L-1min-1
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料Mg0:MgSO4(s)+CO(g) ![]() MgO(s)+CO2(g)+SO2(g)△H>0 该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s)+CO2(g)+SO2(g)△H>0 该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是

选项 | x | y |
A | 压强 | CO2与CO的物质的量之比 |
B | 温度 | 容器内混合气体的密度 |
C | MgSO4的质量(忽略体积) | CO的转化率 |
D | SO2的浓度 | 平衡常数K |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,浓度均为0.10 mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随![]() 的变化如图所示,下列叙述正确的是( )
的变化如图所示,下列叙述正确的是( )
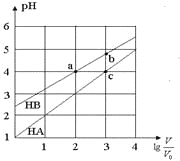
A. 该温度下HB的电离平衡常数约等于1.11×10-5
B. 当![]() 时,若两溶液同时升高温度,则
时,若两溶液同时升高温度,则![]() 减小
减小
C. 相同条件下NaA溶液的pH大于NaB溶液的pH
D. 溶液中水的电离程度:a=c>b
查看答案和解析>>
科目: 来源: 题型:
【题目】已知25℃、101kPa下,如右图所示,石墨的燃烧热为393.5kJ/mol,金刚石的燃烧热为395.0kJ/mol 。下列说法或表达正确的是:
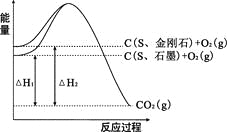
A.金刚石比石墨稳定
B.C(s、石墨)=C(s、金刚石) △H =+1.5kJ/mol
C.△H1<△H2
D.如果使用催化剂,△H1和△H2都变小
查看答案和解析>>
科目: 来源: 题型:
【题目】为探究外界条件对反应:mA(g) +nB(g)![]() cZ(g) △H的影响,以A和B物质的量之比为 m:n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示。下列判断正确的是( )
cZ(g) △H的影响,以A和B物质的量之比为 m:n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示。下列判断正确的是( )
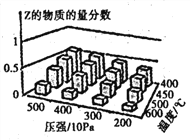
A.在恒温恒容条件下,向已达到平衡的体系中加入少量Z,平衡正向移动,Z的含量增大
B.升高温度,正、逆反应速率都增大,平衡常数增大
C.△H<0 m + n >c
D.△H>0 m +n<c
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,下列说法中正确的是
A.室温下,盐酸中c(Cl-)与醋酸溶液中c(CH3COO-)相等,则两溶液的pH相等
B.将amol·L-1的醋酸溶液与0.01mol·L-1的氢氧化钠溶液等体积混合,溶液中:c(Na+)=c(CH3COO-),则醋酸的电离常数K=![]() (用含a的代数式表示)
(用含a的代数式表示)
C.向NH4Cl溶液中加入少量等物质的量浓度的稀盐酸,则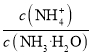 的值减小
的值减小
D.向Na[Al(OH)4]溶液中逐滴加入稀盐酸至沉淀恰好消失时:c(Cl-)=3c(Al3+)
查看答案和解析>>
科目: 来源: 题型:
【题目】纯碱是玻璃、制皂、造纸、纺织和漂染等工业的基本原料。
Ⅰ.世界最早工业生成纯碱的方法是路布兰(N.Leblanc)法,其流程如图:

(1)流程Ⅰ的反应是___反应(填“氧化还原”或“非氧化还原"),流程Ⅱ的反应是分步进行的,a.Na2SO4(s)与过量木炭反应生成Na2S(s);b.Na2S(s)与石灰石发生复分解反应生成Na2CO3,a步的反应化学方程式为___。
Ⅱ.19世纪60年代后生产纯碱的路布兰法被索尔维(E.Solvay)氨碱法所取代,其生产流程如图:
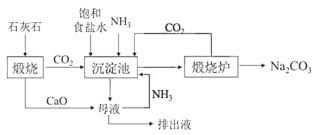
(2)氨碱法中加入NH3的主要作用是___。
(3)与路布兰法相比,氨碱法的优点有___。(写出一条即可)
Ⅲ.1939年候德榜首先提出并自行设计了联合制碱法——利用合成氨工业上的NH3和CO2和NaCl为原料生产纯碱。
(4)侯德榜制碱法的关键还在于对从反应后的混合物中分离出NaHCO3后所得溶液的处理:在溶液中加入NaCl固体并通入NH3,并在___(填温度范围)下析出NH4Cl。
表1不同温度下NaCl和NH4Cl的溶解度数据(g/100g水)
0℃ | 10℃ | 20℃ | 30℃ | 40℃ | |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 |
查看答案和解析>>
科目: 来源: 题型:
【题目】某无色溶液中可能含有H+、OH-、Na+、K+、NO![]() ,加入铝粉后,只产生H2,为探究该溶液中存在的离子,某学习小组进行了如下实验。
,加入铝粉后,只产生H2,为探究该溶液中存在的离子,某学习小组进行了如下实验。
(1)甲同学分析“若H+大量存在,则NO![]() 就不能大量存在”,设计实验证实如下:
就不能大量存在”,设计实验证实如下:
装置 | 现象 |
| Ⅰ.实验初始,未见明显现象 Ⅱ.过一会儿,出现气泡,液面上方出现浅棕色气体 Ⅲ.试管变热,溶液沸腾 |
①现象Ⅲ产生的原因___。
②根据现象Ⅱ,推测溶液中产生了NO,为进一步确认,进行如下实验:
实验 | 内容 | 现象 |
实验1 | 将湿润KI—淀粉试纸置于空气中 | 试纸未变蓝 |
实验2 | 用湿润KI—淀粉试纸检验浅棕色气体 | 试纸变蓝 |
实验1、2说明反应生成了NO。
请用化学方程式解释气体变为浅棕色的原因___。
(2)乙同学分析“若OH-大量存在,NO![]() 也可能不大量存在”,重新设计实验证实如下:
也可能不大量存在”,重新设计实验证实如下:
装置 | 现象 |
| Ⅰ.实验初始,未见明显现象 Ⅱ.过一会儿,出现气泡,有刺激性气味 |
为确认:"刺激性气味”气体,进行如下实验:用湿润KI—淀粉试纸检验,未变蓝;用湿润红色石蕊试纸检验,试纸变蓝。
产生该刺激性气味气体的离子方程式是___。
(3)甲、乙两位同学设计的实验初始时均未见明显现象的原因是___。
(4)根据以上实验分析,该溶液中一定大量存在的离子是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com