
科目: 来源: 题型:

⑴有右下图所示A、B、C、D四种仪器:请选择下列仪器名称的序号,填入相应的空格内:
①蒸馏烧瓶②普通漏斗③圆底烧瓶④锥形瓶⑤分液漏斗⑥酸式滴定管⑦碱式滴定管
A___________ B_________C_________D_________
⑵某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图.由图中可以看出,该同学在操作时的一个错误是__________,烧杯的实际质量为__________g.

⑶指出下面3个实验中各存在的一个错误:

A_____________,B________________,C__________________
查看答案和解析>>
科目: 来源: 题型:
工业上生产氯气,常用在电解槽中电解饱和食盐水的方法,为了避免电解产物之间发生反应,常用阳离子交换膜将电解槽隔成两部分。下图(左图)为电解槽的示意图。

(1)这种阳离子交换膜,只允许溶液中的 通过。(填下列微粒的编号)
①H2 ②Cl2 ③H+ ④Cl- ⑤Na+ ⑥OH-
(2)写出在电解过程中发生的电极方程式
阳极: 。
(3)已知某电解槽每小时加入10%的氢氧化钠溶液10kg,每小时能收集到标况下的氢气896L,而且两边的水不能自由流通。则理论上计算,电解后流出的氢氧化钠溶液的质量分数为 。
(4)某化学课外兴趣小组设计了用电解法制取乙醇钠的工业方法,所用的电解槽如上右图所示,设计要求:①所用的交换膜不能让分子自由通过;②电解过程中消耗的原料是氢氧化钠和乙醇。回答下列问题:
①写出在电解过程中发生的电极方程式
阴极: 。
②最后从乙醇钠的乙醇溶液中分离得到纯净乙醇固体的方法是: 。
查看答案和解析>>
科目: 来源: 题型:
电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:

(1)X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同
时在两边各滴入几滴酚酞试液,则电解池中总反应的离子方程式
为 ,在X极附近 观察到的实验现象是 。检
验Y电极反应产物的方法是 (2)若想用电解实验制得白色纯净的Fe(OH)2沉淀,a仍是饱和
NaCl溶液,则Y电极反应式为 ,
往U形管添加完饱和NaCl溶液后需加入少量苯,苯的作用是
(3)若想用电解方法精炼粗铜,电解液a选用CuSO4溶液,则X电极的材料是 Y电极反应式为 。
查看答案和解析>>
科目: 来源: 题型:
亚氯酸钠(![]() )是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:

已知:
①![]() 的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2?3H2O;
的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2?3H2O;
②纯![]() 易分解爆炸,一般用稀有气体或空气稀释到10%以下。
易分解爆炸,一般用稀有气体或空气稀释到10%以下。
(1)发生器中鼓入空气的作用可能是________________________________;
(2)吸收塔内发生反应的化学方程式为______________________________;吸收塔内的温度不能超过![]() ,其目的是防止
,其目的是防止![]() 分解,写出
分解,写出![]() 分解的化学方程式____________________________________;
分解的化学方程式____________________________________;
(3)在碱性溶液中![]() 比较稳定,所以吸收塔中应维持
比较稳定,所以吸收塔中应维持![]() 稍过量,判断
稍过量,判断![]() 是否过量的简单实验方法是_________________________________;
是否过量的简单实验方法是_________________________________;
(4)从滤液中得到NaClO2?3H2O粗晶体的实验操作依次是____________
查看答案和解析>>
科目: 来源: 题型:
向一定体积的密闭容器中加入![]() 和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图I所示,其中
和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图I所示,其中![]() 阶段
阶段![]() 未画出。图Ⅱ为
未画出。图Ⅱ为![]() 时刻后改变反应条件,化学反应速率随时间变化的情况,四个阶段改变的条件均不相同,每个阶段只改变浓度、温度、压强、催化剂中的一个条件,其中
时刻后改变反应条件,化学反应速率随时间变化的情况,四个阶段改变的条件均不相同,每个阶段只改变浓度、温度、压强、催化剂中的一个条件,其中![]() 阶段为使用催化剂。
阶段为使用催化剂。

请回答下列问题:(1)若![]() ,则
,则![]() 阶段以C物质的浓度变化表示的反应速率为_________;
阶段以C物质的浓度变化表示的反应速率为_________;
(2)![]() 阶段改变的条件为___________,B的起始物质的量浓度为______________。各阶段平衡时对应的平衡常数如下表所示:
阶段改变的条件为___________,B的起始物质的量浓度为______________。各阶段平衡时对应的平衡常数如下表所示:
|
|
|
|
|
|
|
|
|
|
|
|
则![]() (保留两位小数),
(保留两位小数),![]() 之间的关系为____________(用“>”、“<”或“=”连接);
之间的关系为____________(用“>”、“<”或“=”连接);
(3) ![]() 阶段保持容器内温度不变,若A的物质的量共变化了
阶段保持容器内温度不变,若A的物质的量共变化了![]() ,而此过程中容器与外界的热交换总量为
,而此过程中容器与外界的热交换总量为![]() ,写出此温度下该反应的热化学方程式__________;
,写出此温度下该反应的热化学方程式__________;
(4)在相同条件下,若起始时容器中加入![]() ,要达到
,要达到![]() 时刻同样的平衡,
时刻同样的平衡,![]() 要满足的条件为________________。
要满足的条件为________________。
查看答案和解析>>
科目: 来源: 题型:
A、B、C在一定条件下进行下列化学反应,请根据以下的转化关系回答下
列问题,已知A、B、C中均含有同一种元素。
1.D为非金属单质,且A、B、C之间存在如下转化关系:
![]()
⑴若A为金属单质, C与水反应能够生成D。写出C的电子式
⑵若A为气态无机物,则C的分子式可能是 (至少填两种)
⑶若A为烃的含氧衍生物,A分子中含有2个碳原子。常温下,23g A完全燃烧放出683.5kJ的热量,写出能表示A燃烧热的热化学方程式
⑷若D为金属单质,且以上反应均为氧化还原反应,请写出检验B中阳离子的一种方法 。
⑸若D为碱,B为白色沉淀,且以上反应均为非氧化还原反应。写出B与D反应的离子方程式 。
查看答案和解析>>
科目: 来源: 题型:
某综合实践活动小组到自来水厂进行参观,了解到源水处理成自来水的工艺流程示意图如下:

(1)源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入CaO后生成Ca(OH)2,进而发生若干复分解反应,试写出其中的一个离子方程式
。
(2)加入凝聚剂可以除去其中的悬浮固体颗粒,其过程是 。
(填写下列各项的序号)
①只有物理过程,无化学过程
②只有化学过程,无物理过程
③既有化学过程又有物理过程
FeSO4?7H2O是常用的凝聚剂,加入后,最终生成红褐色胶状沉淀,则这种红褐色胶状沉淀是 。
(3)通入二氧化碳的目的是
和
(4)气体A的作用是 。
(5)下列物质中, 可以作为气体A的代替品。(填写下列各项的序号)
①ClO2 ②浓氨水 ③SO2 ④浓硫酸
查看答案和解析>>
科目: 来源: 题型:
下列图1中B是一种常见的无色无味的液体。C是一种有磁性的化合物,E是一种无色无味的有毒气体。根据下列图1、图2,回答下列问题:
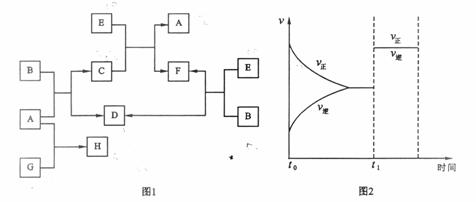
(1)写出C的化学式: 。
(2)E和N2是等电子体,请写出可能E的电子式:
(3)在101kPa和150℃时,可逆反应E(g) + B(g)![]() F(g) + D(g)反应速率和时间的关系如图2所示,那么在t1时速率发生改变的原因可能是(填选项字母) 。
F(g) + D(g)反应速率和时间的关系如图2所示,那么在t1时速率发生改变的原因可能是(填选项字母) 。
A.升高温度 B.增大压强 C.加入催化剂
(4)若G是一种淡黄色固体单质,16 g G和足量的A反应放出的热量为Q kJ(Q > 0),写出这个反应的热化学方程式: 。
若G是一种气态单质,H的水溶液可以和有机物I反应使溶液呈紫色,请写出I的结构简式: ;H的水溶液呈酸性,请用离子方程式表示呈酸性的原因:
查看答案和解析>>
科目: 来源: 题型:
辉钼矿(MoS2)是钼最重要的矿物。图1是辉钼矿多层焙烧炉的示意图,其中1,2,3,…是炉层编号。580,600,610,…是各炉层的温度(℃)。图2给出了各炉层的固体物料的摩尔百分组成。
已知:MoS2焙烧生成1molMoO3的反应热为ΔH1=-1011KJ/mol,MoO2氧化生成1molMoO3的反应热为ΔH2=-154KJ/mol。试回答:

图1 图2
(1)辉钼矿焙烧生成MoO3的反应中被氧化的元素是: ;指出辉钼矿焙烧生成的尾气对环境的一种危害: 。
(2)第6炉层存在的固体物质分别是: ;它们的物质的量之比是: 。
(3)辉钼矿焙烧生成MoO3的热化学反应方程式是: 。
(4)图26―2表明,中间炉层(4~6)可能存在一种“固体+固体→固体+…”的反应,请写出该反应的化学方程式: 。
(5)通过(3)和(4)你能解释为什么中间炉层(4~6)的炉温比上下炉层的炉温低吗? 。
查看答案和解析>>
科目: 来源: 题型:
Ⅰ)如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g)![]() 2C(g);反应达到平衡后,再恢复至原温度。回答下列问题:
2C(g);反应达到平衡后,再恢复至原温度。回答下列问题:
(1)可根据 现象来判断甲、乙都已达到平衡。
(2)达到平衡时,隔板K最终停留在0刻度左侧a处,
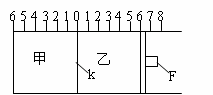
则a的取值范围是 (3)若达到平衡时,隔板K最终停留在左侧刻度1处,则甲中C的物质的量为 mol,乙中C的转化率 ______50%(填:>、<、=),此时,乙中可移动活塞F最终停留在右侧刻度 处(填下列序号)① <6 ② >6 ③ =6。
(4)若达到平衡时,隔板K最终停留在左侧刻度靠近0处,则乙中可移动活塞F最终停留在右侧的刻度不大于 ;若K最终停留在左侧刻度靠近2处,则乙中F最终停留在右侧的刻度不小于 。
(Ⅱ)若一开始就将K、F固定,其他条件均不变,则达到平衡时:
(1)甲、乙中C的摩尔分数是 (填:“甲>乙”或“甲<乙”或“甲=乙” );
(2)测得甲中A的转化率为b,则乙中C的转化率为 ;
(3)假设乙、甲两容器中的压强比用d表示,则d的取值范围是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com