
科目: 来源: 题型:
下列离子方程式中,正确的是
A.电解饱和食盐水:2Cl-+2H2O![]() H2↑+C12↑+2OH-
H2↑+C12↑+2OH-
B.在氯化铝溶液中加入过量氨水:Al3+ + 4NH3•H2O = AlO![]() + 4NH
+ 4NH![]() +2H2O
+2H2O
C.小苏打溶液与稀硫酸混合:CO![]() +2H+==CO2↑+H2O
+2H+==CO2↑+H2O
D.过量铁粉与氯化铁溶液反应:Fe+Fe3+=2Fe2+
查看答案和解析>>
科目: 来源: 题型:
实验是化学研究的基础,关于下列各实验装置图的叙述中,正确的是
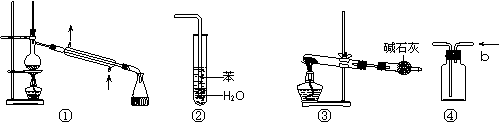
A.装置①常用于分离互不相溶液体混合物
B.装置②可用于吸收HCl气体,并防止倒吸
C.以NH4HCO3为原料,装置③可用于实验室制备少量NH3
D.装置④b口进气可收集CO2、NO等气体
查看答案和解析>>
科目: 来源: 题型:
下列各组离子一定能大量共存的是
A.在含有大量SO42-的溶液中:Na+、Mg2+、Ba2+、CO32-
B.在使酚酞试液变红的溶液:Na+、Ba2+、Cl-、OH-
C.在由水电离产生的c(H+)=1×10-13mol?L-1的溶液中:NH4+、K+、HCO3-、Cl-
D.在与Al反应生成H2的溶液中:H+、NH4+、SO42-、NO3-
查看答案和解析>>
科目: 来源: 题型:
设NA为阿伏加德罗常数,下列说法正确的是
A.200mL1mol/LAl2(SO4)3溶液中,Al3+和SO2-4离子总数为NA
B.1.0L 1.0mol?L-1CH3COOH溶液中,所含有的CH3COO-离子数为NA
C.0.1mol![]() Br原子中含中子数为 3.5NA
Br原子中含中子数为 3.5NA
D.标准状况下,22.4L甲烷中含共用电子对总数为4NA
查看答案和解析>>
科目: 来源: 题型:
下列有关表述中正确的一组是
A.H216O、D216O、H218O、D218O互为同素异形体
B.H和D是同一种核素
C.图标 所警示的是:当心火灾――易燃物质
所警示的是:当心火灾――易燃物质
D.二氧化碳分子的球棍模型:![]()
查看答案和解析>>
科目: 来源: 题型:
(11分)海南省是海洋大省,海水是一种丰富的资源,工业上从海水中可提取许多种物质,广泛应用于生活、生产、科技等方面。下图是某工厂对海水资源进行综合利用的示意图。
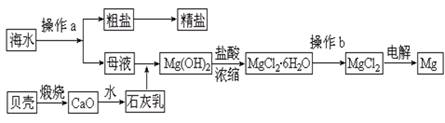
回答下列问题:
⑴流程图中操作a的名称为 。
⑵工业上从海水中提取的NaCl,可用来制取纯缄,其简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱。
①则气体A应是 (填化学式)其过程反应方程式为_________________________。
②滤液D中主要含有NH4Cl、NaHCO3等物质,工业上是向滤液D中通入NH3,并加入细小食盐颗粒,冷却析出不含有NaHCO3的副产品NH4Cl晶体,则通入NH3的作用是
。
⑶镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。高考资源网操作b是在
气氛中进行,若在空气中加热,则会水解生成Mg(OH)Cl,写出有关反应的化学方程式___________________________________________________________。
⑷一氯碱厂每天消耗234吨NaCl,这些NaCl能生产质量分数为32%的烧碱溶液________吨,同时消耗______________库电量(1电子电量1.60×10-19C)
查看答案和解析>>
科目: 来源: 题型:
钛已作为常用金属铁、铝后的第三金属,我国钛矿储量丰富,它的应用研究是目前科学研究的前沿之一。 2007年诺贝尔物理学奖为法国科学家阿尔贝。费尔和德国科学家彼得.格林贝格尔共同获得,以表彰他们在巨磁电阻效应(MR效应)研究方面的成就,某钙钛型复合氧化物(如右图),以A原子为晶胞顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Ti、Fe时,这种化合物具有CMR效应。
⑴写出该晶体的化学式________________
⑵Ti的核外电子排布式为________它位于周期表中________区,价电子排布为________。
 ⑶锰的电负性为1.99。Cr的电负性为1.66,说明锰的金属性比铬_____(强、弱)
⑶锰的电负性为1.99。Cr的电负性为1.66,说明锰的金属性比铬_____(强、弱)
⑷最近发现钛(Ti)原子和碳原子构成气态团簇分子,分子模型如图。则其化学式为______。它属于______晶体,其主要物理性质____________ __________(写出2个即可)
查看答案和解析>>
科目: 来源: 题型:
(10分)烃X是一种重要的化工原料。X能使Br2的四氯化碳溶液褪色,它的密度是同温同压下氢气密度的21倍。由烃X经下列反应可制得A~F等多种有机物。
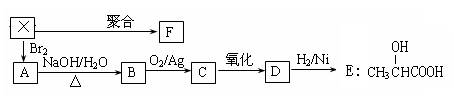
已知:RCH2Br + NaOH → RCH2OH + NaBr
⑴烃X的结构简式为 ,F的结构简式为 。
⑵由X→A、B→C的反应类型分别为 、 。
⑶B转化为C的化学方程式: ;
⑷在一定条件下,两分子E能脱去两分子水形成一种六元环状化合物G,G的结构简式为: 。
查看答案和解析>>
科目: 来源: 题型:
(12分).某校化学研究性学习小组设计如下实验方案,测定放置已久的小苏打样品中纯碱的质量分数。
⑴方案一:称取一定质量的样品,置于坩埚中加热至恒重后,冷却,称取剩余固体质量,计算。实验中加热至恒重的目的是____________。
⑵方案二:按下图装置进行实验。并回答以下问题。
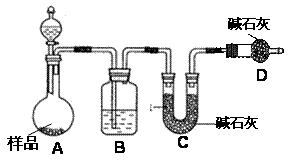
①实验前先_____________________。分液漏斗中应该装_____(盐酸或硫酸)。D装置的作用是______________________________________。
②实验中除称量样品质量外,还需称__________________装置前后质量的变化。
③根据此实验得到的数据,测定结果有误差。因为实验装置还存在一个明显缺陷,该缺陷是 _______________________________________________。
⑶方案三:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量氯化钡溶液。过滤洗涤,干燥沉淀,称量固体质量,计算:
①过滤操作中,除了烧杯,漏斗外还用到的玻璃仪器有_______________。
②实验中判断沉淀是否完全的方法是____________________________。
③如加入试剂改为氢氧化钡,已知称得样品10.5g,干燥的沉淀质量为19.7g,测样品中碳酸钠的质量分数为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com