
科目: 来源: 题型:
下列化学反应中,属于氧化还原反应的是
A.Na2CO3+CaCl2===CaCO3↓+2NaCl
B.Fe+CuSO4===Cu+FeSO4
C.2NaHCO3![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
D.CaO+H2O===Ca(OH)2
查看答案和解析>>
科目: 来源: 题型:
目前排放到空气中的CO2逐年增加,对此科学家最担心的是
A.会使空气中的氧含量下降,不足以供给人类呼吸
B.会使地球温度升高,冰川融化,生态失衡
C.会使人体吸进大量CO2,损害健康
D.会使石灰岩大量溶解,破坏自然风光
查看答案和解析>>
科目: 来源: 题型:
恒温下,将a mol N2与b mol H2的混合气体通入一个容积为2L的密闭容器中,发生如下反应: N2 (g) + 3 H2(g) ![]() 2NH3(g)
2NH3(g)
若反应进行到5min时,测得n (N2) = 13mol,n (NH3) = 6mol,计算a值及N2的起始浓度(要有计算过程)
查看答案和解析>>
科目: 来源: 题型:
在由铜锌组成的原电池(电解质是稀硫酸)中,有位同学在铜电极收集到了标准状况下22.4L的气体,
(1) ![]() (1分)铜锌原电池的总反应的离子方程式为:________________________________________________________________________
(1分)铜锌原电池的总反应的离子方程式为:________________________________________________________________________
(2) (3分)铜电极产生标准状况下22.4L气体的过程中有多少克的锌溶解?
查看答案和解析>>
科目: 来源: 题型:
某研究性学习小组用0.20mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其实验探究操作为如下几步:
① 用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
② 固定好滴定管并使滴定管尖嘴充满液体
③ 调节液面至“0”或“0”刻度线稍下,并记下读数
④ 移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤ 用标准液滴定至终点,记下滴定管液面读数。
实验结果和真实浓度差别很大,在指导老师帮助下对重点环节进行了反思、分析,请你也参与评价并请回答:
(1)以上步骤有错误的是(填编号) ,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”)__________________
 (2)步骤⑤中,在记下滴定管液面读数时,滴定管尖嘴有气泡,将导致测定结果(填“偏大”、“偏小”或“无影响”)___________________
(2)步骤⑤中,在记下滴定管液面读数时,滴定管尖嘴有气泡,将导致测定结果(填“偏大”、“偏小”或“无影响”)___________________
(3)判断滴定终点的现象是:锥形瓶中溶液从 色变为 色,且半分钟不变色。
(4)右图是某次滴定时的滴定管中的液面,其读数为 mL
查看答案和解析>>
科目: 来源: 题型:
电解原理在化学工业中有广泛应用。如图示,是一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
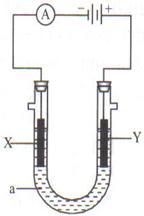 (1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应式是:
______________________________________________________
在X极附近观察到的现象是:![]() _____________________________
_____________________________
______________________________________________________
②Y电极上的电极反应式是:_____________________________
检验该电极反应产物的方法是:___________________________
_____________________________________________________。
总反应化学方程式是:_____________________________________。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是_________。②Y电极的材料是_________。
(3)若要在铁钉表面镀铜,则电解液a选用_______________,X电极的材料是____________,Y电极的材料是_________________。
查看答案和解析>>
科目: 来源: 题型:
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。
(1)反应的热化学方程式为 ![]() 。
。
(2)又已知H2O(l) = H2O(g) ΔH= +44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。[来源:]
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点 ![]()
![]() .
.
查看答案和解析>>
科目: 来源: 题型:
(1)常温下,0.05mol/L硫酸溶液中,c(H+)= mol/L,pH值为 ,水电离的c(H+)= mol/L
(2)已知下列物质在20 ℃下的Ksp如下:
| 化学式 | AgCl | AgBr | AgI |
| 颜 色 | 白色 | 浅黄色 | 黄色 |
| Ksp | 2.0×10-10 | 5.4×10-13 | 8.3×10-17 |
①20℃时,上述三种银盐的饱和溶液中,Ag+物质的量浓度由大到小的顺序是:
。
②向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,c(Br-)/c(Cl-)= 。
(3)物质的量浓度相同的①氨水、②氯化铵、③碳酸氢铵、④硫酸氢铵、⑤硫酸铵5种溶液中,c(NH![]() )的大小顺序是 (填序号)。
)的大小顺序是 (填序号)。
(4)浓度均为0.1mol/L的8种溶液 ① HNO3 ② H2SO4 ③ CH3COOH
④ Ba(OH)2 ⑤ NaOH ⑥ CH3COONa ⑦ KCl ⑧ NH4Cl,溶液PH由大到小的顺序是(填写编号)
(5)将AlCl3溶于水后,经加热蒸发、蒸干,灼烧,最后所得白色固体的主要成分是 ________
查看答案和解析>>
科目: 来源: 题型:
合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g) ![]() 2NH3(g) △H= -92.4KJ/mol ,据此回答以下问题:
2NH3(g) △H= -92.4KJ/mol ,据此回答以下问题:
(1)下列有关该反应速率的叙述,正确的是(选填序号) ![]() 。
。
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强不能增大活化分子百分数,所以不可以加快反应速率
c.使用催化剂可以使反应物分子平均能量升高,加快反应速率
d.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
(2)①该反应的化学平衡常数表达式为K=_______________________。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越_____ 。
(3)某温度下,若把10 mol N2与30 mol H2 置于体积为10 L的密闭容器内,反应达到平衡状态时,测得平衡混合气体中氨的体积分数为20%,则该温度下反应的K=___________(可用分数表示)。能说明该反应达到化学平衡状态的是_________ (填字母)。[来源:学*科*网Z*X*X*K]
a.容器内的密度保持不变 b.容器内压强保持不变
c.υ正(N2)=2υ逆(NH3) d.混合气体中 c(NH3)不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com