
科目: 来源: 题型:
相对分子质量为92的某芳香烃X是一种重要的有机化工原料,研究部门以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。其中A是一氯代物,H是一种功能高分子,链节组成为C7H5NO。

已知:
Ⅰ ![]()
Ⅱ ![]() (苯胺,易被氧化)
(苯胺,易被氧化)
请根据所学知识与本题所给信息回答下列问题:
⑴x的化学式是 ;
⑵H的结构简式是___________________________;
⑶反应②的类型是 ;
⑷反应⑤的化学方程式是_________________________ _____;
⑸![]() 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有 种;
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有 种;
⑹请用合成反应流程图表示出由![]() 和其他无机物合成
和其他无机物合成 最合理的方案(不超过4步)。
最合理的方案(不超过4步)。
例:
![]()
![]()

查看答案和解析>>
科目: 来源: 题型:
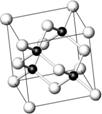 砷化镓(GaAs)属于第三代半导体,用它制造的灯泡寿命是普通灯泡的100倍,而耗能只有其10%。推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措。砷化镓的晶胞结构如右图。
砷化镓(GaAs)属于第三代半导体,用它制造的灯泡寿命是普通灯泡的100倍,而耗能只有其10%。推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措。砷化镓的晶胞结构如右图。
试回答:
(1)As的核外电子排布式为 。
(2)砷化镓晶胞中所包含的Ga原子个数为 。
(3)下列说法正确的是 (填字母)。
A.砷化镓晶胞结构与NaCl相同 B.第一电离能:As>Ga
C.电负性:As>Ga D.砷化镓晶体中含有配位键
E.半导体GaP与GaAs互为等电子体
(4)砷化镓是将(CH3)3Ga和AsH3用MOCVD方法在700℃时制备得到。
AsH3的空间形状为 ,(CH3)3Ga中镓原子的杂化方式为 。
(5)AsH3沸点比NH3低,其主要原因是 。
查看答案和解析>>
科目: 来源: 题型:
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO·Cr2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,涉及的主要反应是:6FeO·Cr2O3+24NaOH+7KClO3![]() 12Na2CrO4+3Fe2O3 +7KCl+12H2O,
12Na2CrO4+3Fe2O3 +7KCl+12H2O,
试回答下列问题:
⑴在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式: 。
⑵NaFeO2能强烈水解,在操作②生成沉淀而除去,写出该反应的化学方程式: 。
⑶操作③的目的是什么,用简要的文字说明: 。
 |
⑷操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式: 。
⑸称取重铬酸钾试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL 2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)。
①判断达到滴定终点的依据是: ;
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品的中重铬酸钾的纯度(设整个过程中其它杂质不参与反应) 。
查看答案和解析>>
科目: 来源: 题型:
 氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产、生活中有着重要作用。
氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产、生活中有着重要作用。
⑴右图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式
⑵在固定体积的密闭容器中,进行如下化学反应:
N2(g)+3H2(g)![]() 2NH3(g) △H < 0 ,
2NH3(g) △H < 0 ,
其平衡常数K与温度T的关系如下表:
| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
①该反应的平衡常数表达式:K=
②试判断K1 K2(填写 “>”“=”或“<”)
③下列各项能说明该反应已达到平衡状态的是 (填字母)
a.容器内N2、H2、NH3的浓度之比为1∶3∶2 b.v(N2)正 = 3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
⑶对反应N2O4(g)![]() 2NO2(g) △H > 0 ,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示,下列说法正确的是 。
2NO2(g) △H > 0 ,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示,下列说法正确的是 。
 a.A、C两点的反应速率:A>C
a.A、C两点的反应速率:A>C
b.A、C两点的化学平衡常数:A>C
c.A、C两点NO2的转化率:A<C
d.由状态B到状态A,可以用加热的方法
![]() ⑷一定温度下,在1L密闭容器中充入1molN2和3molH2并发生反应。若容器容积恒定,10min达到平衡时,气体的总物质的量为原来的 ,则N2的转化率a(N2)= , 以NH3表示该过程的反应速率v(NH3)= 。
⑷一定温度下,在1L密闭容器中充入1molN2和3molH2并发生反应。若容器容积恒定,10min达到平衡时,气体的总物质的量为原来的 ,则N2的转化率a(N2)= , 以NH3表示该过程的反应速率v(NH3)= 。
查看答案和解析>>
科目: 来源: 题型:
如下图所示物质间的相互转变关系,反应①在工业上可用来生产化合物C,反应⑤在工业上可生产化合物J(Na2FeO4),反应①、②、④和⑤均是在水溶液中进行的反应.常温下D、E、G均是气体,B是无色液体;F的水溶液可作为杀菌消毒剂;H是一种铁矿石的主要成分,它由两种元素组成,且其中铁元素的质量分数为70%.

请回答下列问题:
⑴写出F的化学式:________________;
⑵人们将反应①涉及的化学工业称为 ________________;
⑶写出电解A、B混合液的阳极反应式 ;
⑷ 写出B与D反应的离子方程式________________________________________;
⑸写出反应④的离子方程式______________________________________________;
⑹写出反应⑤的离子方程式______________________________________________;
⑺高铁酸钠(Na2FeO4)被人们认为是一种“绿色环保高效”的净水剂,其原因为:
①Na2FeO4具有强氧化性可杀菌消毒;
②___________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备 CuSO4·5H2O及纳米材料G,步骤如下:
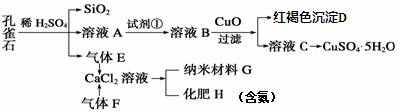
请回答下列问题:
⑴溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①最佳为_____(填代号)。
a.KMnO4 b.(NH4)2S c.H2O2 d.KSCN
向溶液B中加入CuO的作用是 。
⑵由溶液C获得CuSO4·5H2O,需要经过 、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是 。
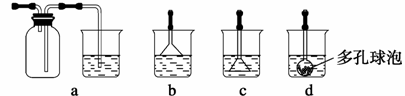
⑶写出制备G的化学反应方程式 。若实验过程中有氨气逸出,应选用下列 装置回收(填代号)。
⑷欲测定溶液A中Fe2+的溶液,可用KMnO4标准溶液滴定,取用KMnO4标准溶液应使用 。取A溶液稀释一定倍数后,用KMnO4标准溶液滴定,终点现象为 。
查看答案和解析>>
科目: 来源: 题型:
已知同温度下的溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2;就溶解或电离出S2-的能力而言,FeS>H2S>CuS,则下列离子方程式错误的是 ( )
A.Mg2+ + 2HCO3- + 2Ca2+ + 4OH- = Mg(OH)2↓+ 2CaCO3↓+ 2H2O
B.Cu2+ + H2S = CuS↓+ 2H+
C.Zn2+ + S2- + 2H2O = Zn(OH)2↓+ H2S↑
D.FeS + 2H+ = Fe2+ + H2S↑
查看答案和解析>>
科目: 来源: 题型:
下列叙述正确的是 ( )
A.NH4+与HCO3_均可以水解,故NH4HCO3是弱电解质
B.25℃时,1LpH=3的盐酸与1LpH=11的氨水能恰好中和
C.25℃时,用pH试纸测定出某醋酸溶液的pH=3.5
D.25℃时,pH=14的溶液中,Na+、CO32-、K+、ClO-可以大量共存
查看答案和解析>>
科目: 来源: 题型:
下图表示取1 mol乙烯雌酚进行的4个实验,下列对实验数据的预测与实际情况吻合的是 ( )

A.①中生成7 mol H2O B.②中生成2 mol CO2
C.③最多消耗3 mol Br2 D.④中最多消耗7 mol H2
查看答案和解析>>
科目: 来源: 题型:
下列实验方案正确且能达到相应实验预期目的的是 ( )
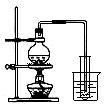



① ② ③ ④
A.①制取少量蒸馏水 B.②用铜和浓硝酸制取少量NO2
C.③比较MnO2、Cl2、 I2的氧化性 D.④探究NaHCO3的热稳定性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com