
2006-2007学年度第一学期期末考试高一试卷
化学
可能用到的相对原子质量
H-
Al-27 S-32 Cl-35.5 Fe-56 Cu-64 Ba-137
第Ⅰ卷(选择题 共40分)
一. 选择题(本题共20小题,每小题2分,共40分。每小题中只有一个选项符合题意。)
1.下面有关氧化还原反应的叙述正确的是
A.反应中不一定所有元素的化合价都发生变化
B.非金属单质在反应中只作氧化剂
C.某元素从化合态变为游离态时,该元素一定被还原
D.金属原子失电子越多,其还原性越强
2.人体血红蛋白中含有Fe2+,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+转化为Fe3+,生成高铁血红蛋白而丧失与O2结合的能力。服用维生C可缓解亚硝酸盐的中毒,这说明维生素C具有 A.酸性 B.碱性 C.氧化性 D.还原性
3.氢化钠(NaH)是生氢剂,可发生如下反应:NaH + H2O == NaOH + H2↑,对这一反应的叙述正确的是
A.NaH是氧化剂 B.NaOH是氧化产物
C.NaOH是还原产物 D.氧化产物和还原产物的质量比是1:1
4.下列离子方程式中正确的是
A.澄清石灰水与盐酸反应:H+ + OH- = H2O
B.铜与稀硝酸反应:Cu + 2H+ = Cu2+ + H2↑
C.稀硫酸与铁反应:2H+ + Fe === Fe3+ + H2↑
D.用醋酸除去保温瓶内壁的水垢:CO + 2H+ = H2O + CO2↑
+ 2H+ = H2O + CO2↑
5.下列物质的用途错误的是
A. 硅是制造太阳能电池的常用材料
B. 二氧化硅是制造光导纤维的材料
C. 水玻璃可用作木材防火剂
D. 硅是制取水泥的原料
6.有关氯气的性质或用途的叙述中,错误的是
A.工业上用氯气与消石灰反应制成漂白粉
B.自来水常用氯气来杀菌,其消毒的有效成分是HClO
C.氯气有毒,制取氯气的尾气要用碱液吸收
D.氢气不能在氯气中燃烧
7.起固定氮作用的化学反应是
A.氮气与氢气在一定条件下反应生成氨气
B.一氧化氮与氧气反应生成二氧化氮
C.氨气经催化氧化生成一氧化氮
D.由氨气制碳酸氢铵和硫酸铵
8.下列各物质相互反应时,能产生可燃烧气体的是
A.红热碳块投入浓硝酸中 B.铁丝投入稀硫酸中
C.过氧化钠投入水中 D.石灰石投入稀盐酸中
9. 在一些高档茶叶、点心等食品的包装盒中有一个小袋,将小袋打开,可以看到灰黑色粉末,其中有些已变成棕褐色。将灰黑色粉末溶于稀盐酸,取上层清液,滴入几滴氯水,再滴加KSCN溶液,马上出现血红色。以下结论不正确的是
A. 该灰黑色粉末用作抗氧化剂
B. 该灰黑色粉末不可食用
C. 小袋中原来装有铁粉
D. 小袋中原来装有氧化铁
10. 设NA代表阿伏加德罗常数,下列说法正确的是
A. 2.7g金属铝变为铝离子时失去的电子数目为0.6NA
B. 在常温、常压下,11.2L N2含有的分子数目为0.5NA
C. 1L 0.3mol?L-1 Na2SO4溶液中含有 和
和 离子总数为0.9NA
离子总数为0.9NA
D. 在K2SO4和NaCl的中性混合水溶液中,如果 和
和 的物质的量浓度相等,则
的物质的量浓度相等,则 和
和 的物质的量浓度一定相同
的物质的量浓度一定相同
11. 下列实验事实,能表示浓硝酸有强氧化性的是
A.. Na2CO3遇浓硝酸放出CO2气体
B. Fe在冷浓硝酸中发生钝化现象
C. 分别沾有浓氨水和浓硝酸的两支玻璃棒互相靠近产生白烟
D. Fe(OH)3不溶于水,但能溶于浓硝酸
12.VL硫酸铁溶液中含有mgFe3+离子,则溶液中SO42-离子的物质的量浓度是
A. B.
B. C.
C. D.
D.
13.配制1mol/L NaCl溶液250mL,在下列仪器中要用到的是
①托盘天平 ②量筒 ③容量瓶 ④滤纸 ⑤烧杯 ⑥玻璃棒 ⑦酒精灯 ⑧试管 ⑨胶头滴管
A.①③⑤⑥⑨ B.②③④⑤ C.①②③⑤⑥
D.②③⑤⑥⑧⑨
14.下列物品的鉴别方法不正确的是
A.用焰色反应鉴别NaCl、KCl和Na2SO4
B.用氢氧化钠溶液鉴别MgCl2溶液和AlCl3溶液
C.利用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液
D.用品红试液鉴别SO2和CO2两种气体
15.由 Fe、FeO、Fe2O3 组成的混合物3.44g,加入 50ml 2.0mol/L的盐酸,二者恰好完全反应。经检验溶液中不含Fe3+,反应过程中产生了标况下气体a L,若不考虑溶液体积改变,溶液中Fe2+的浓度是( )
A.1.0mol/L B. 1.2mol/L C. 1.5mol/L
D.因a值不确定,无法计算
16.下列关于胶体的说法中正确的是
A.胶体的外观不均匀
B.胶粒不能透过滤纸
C.胶粒做不停的、无秩序的运动
D.胶粒不稳定,静置容易产生沉淀
17.下列实验操作错误的是
A.分液时,分液漏斗中的下层液体和上层液体要依次从分液漏斗下口放出
B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口处
C.过滤时,玻璃棒放在三层滤纸处
D.用四氯化碳萃取碘水中的碘
18.下列说法正确的是
A. SiO2不溶于水,也不溶于任何酸
B. 硅酸的酸性比碳酸强
C.玻璃中含有SiO2,一定条件下要与NaOH溶液反应
D. CO2和SiO2可发生化合反应
19.以下物质间的每步转化通过一步反应能实现的是
A. Al-Al2O3-Al(OH)3-NaAlO2
B. .Fe-FeCl2-Fe(OH)2-Fe(OH)3
C. S-SO3-H2SO4-MgSO4
D. .N2-NO2-HNO3 -NO
20.在100 mL混合液中,HNO3和H2SO4的物质的量浓度分别是0.4mol/L 和0.1 mol/L 。向该混合液中加入1.92 g Cu粉,加热充分反应后,所得溶液Cu2+的物质的量浓度是
A . 0.15 mol/L B. 0.225 mol/L C . 0.35 mol/L D . 0.45 mol/L
2006-2007学年度第一学期期末考试高一试卷
化学
第Ⅱ卷(非选择题 共60分)
二、填空题(共16分)
21.(5分) (1)与16g氧气所含的分子数相同的氨气是 g;与16g氧气所含的原子总数相同的氨气是 g;相同条件下,在5.6g氮气中添加 g氨气,所组成的混合气体的体积与16g氧气所占的体积相等。
.(2)4.6g Na放在 g水中,才能使每10个水分子中溶有一个Na+。
22.(4分)合理利用化学反应可以造福人类。请写出下列反应的化学方程式、
(1)印刷电路板是由高分子材料和铜箔复合而成,可用FeCl3溶液作“腐蚀剂”刻制印刷电路
(2)工业上使用漂白粉的原理
23.(7分)下图每一方格表示一种物质。通常状况下,A、C均为无色气体,B为无色液体。

请填写下列空白:
(1) 物质X可以是___________,C是____________,F是___________;
(2) 反应①的化学方程式是 。
(3) 反应②的离子方程式是 。
三、探究题(共32分)
24.(4分)化学课上,围绕硫酸及其盐的性质进行如下探究,请你填写有关答案。
(1)取一小粒金属钠,小心放入盛有硫酸铜稀溶液的烧杯中,用漏斗倒扣在烧杯上,观察到金属钠在液面上四处游动,有大量气泡生成,收集产生的气体并点燃,火焰呈淡蓝色,该气体是 (填化学式)。溶液中同时有 (填化学式)不溶物生成。
(2)“绿色化学”要求综合考虑经济、技术、环保等方面来设计化学反应路线。若以铜为原料制取硫酸铜,请你设计符合“绿色化学”思想的反应路线(用化学方程式表示)。
。
25.(8分)胃酸过多是常见的胃病,胃酸的主要成分是盐酸。下面是甲、乙两种常见胃药的说明摘要。
甲:(1)白色结晶状粉末,可缓缓分解;(2)能溶于水,水溶液呈弱碱性;(3)遇酸及酸性药物则产生二氧化碳;(4)胃酸过多患者服用多见胃胀气,甚至有引起胃溃疡穿孔的危险。
乙:(1)与胃酸是中和作用缓慢而持久,可维持3~4小时。(2)凝胶本身覆盖于溃疡面上,具有保护作用。(3)可溶于稀酸或氢氧化钠溶液中。
(1)请你推测,甲中含有的主要化学成份是 (填化学式);乙中含有的主要化学成份是 (填化学式)。
(2)试写出甲中含有的主要化学成份引起胃胀气反应的离子方程式:
。
(3)试写出乙中含有的主要化学成份分别与稀盐酸和氢氧化钠溶液反应的离子方程式:
26.(3分)已知Cl2+H2O=HCl+HClO。为了探究HClO的漂白性,某同学设计了如下的实验。
(1)通入Cl2后,从集气瓶A中干燥的红色布条的现象可得出的结论是 ;
从集气瓶B中湿润的红色布条的现象可得出的结论是 。
(2)为了确证是HClO使湿润的红色布条褪色,你认为还应增加的实验是
。
27.(11分).某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验时,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫外,还可能产生氢气。为验证甲、乙两同学的判断是否正确,丙同学设计了如下所示的实验装置(锌与浓硫酸共热时产生的气体为X,且该装置略去)
试回答:
(1)上述反应中生成二氧化硫的化学方程式为 。
(2)乙同学认为还可能产生氢气的理由是:
(3)丙同学在安装好装置后,必不可少的一步 操作是:
。
(4)A中加入的试剂可能是 作用是 。
B中加入的试剂可能是 作用是 。
E中加入的试剂可能是 作用是 。
(5)可以证明气体X中含有氢气的实验现象是:
C中: ,D中 ;
如果去掉装置B,还能否根据D中现象判断气体X中是否有氢气?
(填“能 ”或“不能” )。原因是:
。
28.(6分)在一条鱼、虾几乎绝迹的小河边,从上游到下游依次有四座工厂:甲、乙、丙、丁,它们排出的废液里,每厂只含有Na2CO3、FeC13、Ca(OH)2、HCl中的一种,某中学环保小组对河水监测发现:①甲处河水呈乳白色,②乙处河水呈红褐色,③丙处河水由浑变清。④丁处产生气泡,河水仍清,请回答:
(1)四座工厂排出的废液里含有的污染物是:
甲 乙 丙 丁
(2)在丁的下游M处取出的河水中,肯定含有的离子是
(3)小河中鱼虾几乎绝迹的原因是
四. 计算题(共12分)
29.(4分)将2.44gBaCl2?xH2O晶体配成100mL溶液,其浓度为0.1mol?L-1。计算:
(1)BaCl2?xH2O晶体中的x= 。
(2)要沉淀25mL此溶液中的Cl-,需要0.2mol?L-1的AgNO3溶液 mL。
30.(8分)将10.5 g镁、铝混合物投入到200mL 6mol/L 的盐酸中全部溶解,放出气体的体积在标准状况下为12.32L。求在所得溶液中至少加入多少毫升浓度为3mol/LNaOH溶液,才能使镁、铝两元素以不同存在形式而分离开?
2006-2007学年度第一学期期末考试高一试卷
化学 答题纸
题号
1
2
3
4
5
6
7
8
9
10
答案
题号
11
12
13
14
15
16
17
18
19
20
答案
二、填空题
21.(1)
(2)
22. (1)
(2)
23. (1)
(2)
(3)
三、探究题
24.(1)
(2)
25. (1)
(2)
(3)
26. (1)
(2)
27.(1)
(2)
(3)
(4)
(5)
28.(1)
(2)
(3)
四、计算题
29.(1) (2)
30.(计算过程)
高一化学试题答案
一.选择题
1 A 2 D 3 D 4 A 5 D 6 D 7 A 8 B 9 D 10 C 11B 12 A 13 A 14. A 15A 16 C 17 A 18 C 19 B 20 B (各2分)
二.填空题
21.(1)8.5 、4.25、 5.1 (各1分) (2)39.6(2分)
22. (1) 2FeCl3 + Cu = CuCl2 + 2FeCl2
(2) Ca(ClO)2 + 2HCl = CaCl2 + 2HClO (各2分)
23. (1)(NH4)2CO3(或NH4HCO3);NH3;NO2
(各1分) (2)2Na2O2+2CO2=2Na2CO3+O2 (3)3Cu+2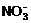 +8H+=3Cu2++4H2O+2NO↑(各2分)
+8H+=3Cu2++4H2O+2NO↑(各2分)
三.探究题
24.(1) H2 Cu(OH)2 (各1分)
(2) 2Cu + O2 = 2CuO CuO + H2SO4 = CuSO4 + H2O(各2分)
25. (1) NaHCO3; Al(OH)3(各1分)
(2) HCO3- + H+ = H2O +CO2↑
(3) Al(OH)3 + 3H+ = Al3+ + 3H2O Al(OH)3 + OH- = AlO2- + 2H2O(各2分)
26. (1) Cl2没有漂白性; HClO有漂白性
(2)盐酸是否能使红布条褪色 (各1分)
27.(1) Zn+2H2SO4(浓)=ZnSO4+SO2↑+2 H2O (2分)
(2)当Zn 与浓硫酸反应时浓硫酸浓度逐渐变稀,Zn与稀硫酸反应可产生H2((1分)
(3)检查装置的气密性(1分) (4)品红溶液;检验SO2; 浓硫酸;吸收水蒸气;碱石灰;;防止空气中水蒸气进入D中(各0.5分)
(5)C中黑色固体变成红色;D中白色粉末变蓝色;不能;因为混合气体中可能含有水,会干扰H2的检验。(各1分)
28.(1)Ca(OH)2、FeCl3、HCl、Na2CO3(各1分)(2)Na+、Ca2+、Fe3+、H+、Cl-(3)河水中的酸、碱等有毒化学试剂直接危害鱼、虾的生存。(各1分)
四.计算题
29.(1)2 (2)25 mL(各2分)
30.500 mL (8分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com