20070120 A.分子式为C10H10O2 B.1 mol该有机物与NaOH溶液反应,可以消耗2 mol NaOH C.1 mol该有机物与Br2的CCl4溶液发生加成反应,可以消耗5 mol Br2
试题详情
 D.分子中所有原子可能在同一平面上 D.分子中所有原子可能在同一平面上
试题详情
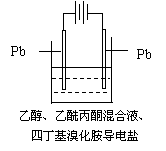
15.有机电解制备的金属醇盐,可直接作为制备纳米材料的前体。以下是一种电化学合成金属醇盐的主要装置。在电解过程中,已知乙醇和乙酰丙酮(CH3COCH2COCH3)在阴极发生的电极反应为: 2CH3CH2OH+2e-=2CH3CH2O-+H2↑ 试题详情
 
下列说法正确的是 A.阳极Pb失去电子,发生还原反应 B.当阳极失去2 mol e―时,阴极产生2 mol氢气 C.电解过程中,阳离子向阴极移动 试题详情
D.已知Pb-4e―=Pb4+,当消耗Pb的质量为103.5 g时,则转移电子2 mol 试题详情
16.某温度下,在密闭容器中存在下列可逆反应:A(g)+2B(g)   4 C(g),达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1,且A的质量分数为w%。保持温度不变,再充入A、B、C的物质的量分别为a、b、c,则下列说法正确的是 4 C(g),达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1,且A的质量分数为w%。保持温度不变,再充入A、B、C的物质的量分别为a、b、c,则下列说法正确的是 A.若为恒容容器,当a∶b∶c为2∶2∶1时,平衡不移动 B.若为恒容容器,当a∶b
=9∶10,且c=0时,达平衡后,A、B、C物质的量之比仍为2∶2∶1 C.若为恒压容器,当a∶b为9∶10,c为任意值时,平衡后A的质量分数一定仍为w% D.若为恒压容器,当a=b=0,且c为任意值时,平衡后A的质量分数小于w% 第Ⅱ卷(非选择题,共86分) 试题详情
三、(本题包括2小题,共22分) 17、(8分)文献资料显示,草木灰主要含有不溶性杂质及K2CO3,还含有少量KCl、K2SO4等。 某化学兴趣小组拟测定草木灰中钾盐的含量及钾盐中K2CO3的含量。 【测定草木灰中钾盐含量】 (1)该实验的主要步骤顺序为:称量.→
→ → → →冷却→再称量(填字母序号)
A. 溶解 B.过滤 C、洗涤、烘干 D、蒸发 (2)称量前,在调整托盘天平的零点时,若指针偏向右边,应将右边的螺丝向 (填左、右)旋动。某学生称量时,在天平右盘加上规定质量的砝码后,在左盘的小烧杯中加入样品,此时指针稍偏右边,该学生的操作应为
。 (3)实验中A、B、C、D三步操作均使用了玻璃棒,操作B中玻璃棒的作用是
,操作D用玻璃棒不断搅动的原因
。 【测定钾盐中K2CO3含量】 (4)取上述操作中所得的钾盐,配成稀溶液,加入CaCl2溶液使CO32-生成沉淀,过滤得到碳酸钙沉淀后,用蒸馏水多次洗涤,烘干、称量、计算。检验沉淀是否完全的方法是
,检验沉淀是否洗净的方法是
。 试题详情
18、(14分)硫酸铜是一种应用极其广泛的化工原料。制备硫酸铜是无机化学实验教学中一个重要的实验。由于铜不能与稀硫酸直接反应,实验中将浓硝酸分次加入到铜粉与稀硫酸中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1、2所示)。 试题详情

(1)图1中,A仪器的名称为
,烧瓶中发生的离子反应方程式为
。 (2)图2是图1的改进装置,改进的目的是
。 (3)为符合绿色化学的要求,某研究性学习小组进行如下设计: 第一组:空气为氧化剂法 方案1:以空气为氧化剂。将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。 试题详情
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加FeSO4或Fe2(SO4)3,反应完全后,向其中加物质甲调节pH到3~4,产生Fe(OH)3沉淀,过滤、蒸发、结晶,滤渣作催化剂循环使用。(已知Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为3.7、6.4。) 请回答下列问题: ①方案1中的B仪器名称是
。 ②方案2中甲物质是
(填字母序号)。a、CaO b、CuCO3 c、CaCO3 第二组:过氧化氢为氧化剂法 试题详情
将3.2g铜丝放到45 mL 1.5mol/L的稀硫酸中,控温在50℃。加入18mL 10%的H2O2,反应0.5h后,升温到60℃,持续反应1 h后,过滤、蒸发结晶、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4?5H2O 10.6g。请回答下列问题: ③该反应的离子反应方程式为
。 ④控制温度在50℃和60℃加热的原因为
,晶体采用酒精淋洗的优点是
。 ⑤上述两种氧化法中,更符合绿色化学理念的是 (填“第一组”或“第二组”),理由是 。 试题详情
四、(本题包括2小题,共18分) 19.(8分)1919年美国化学家埃文?朗缪尔(Langmuir)提出:价电子(最外层电子)数和重原子(即比氢重的原子)数相同的分子(或离子)互称为等电子体。等电子体的结构相似、物理性质相近,称为等电子原理。如N2和CO为等电子体。下表为部分元素等电子体分类、空间构型表。 等电子体类型 代表物质 空间构型 四原子24电子等电子体 SO3 平面三角型 四原子26电子等电子体 SO32- 三角锥型 五原子32电子等电子体 CCl4 四面体型 六原子40电子等电子体 PCl5 三角双锥型 七原子48电子等电子体 SF6 八面体型 试回答: (1)下面物质分子或离子的空间构型: BrO3― ,CO32- ,
HClO4
。 (3)SF6的空间结构如图1所示,请在按照图1表示方法在图2中表示OSF4分子中O、S、F原子的空间位置。已知OSF4分子中O、S间为共价双键,S、F间为共价单键。 试题详情
(2)由第一、二周期元素组成,与F2互为等电子体的分子有 、 (写两种)离子有 。(写一种)
试题详情
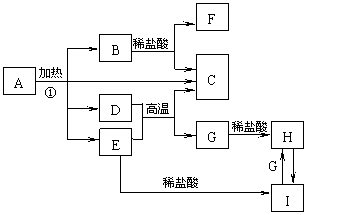 20.(10分)化合物A是一种重要的光化学试剂,属不含结晶水的复盐。A~H之间相互转化关系如下图所示:(部分反应物、生成物没有列出) 20.(10分)化合物A是一种重要的光化学试剂,属不含结晶水的复盐。A~H之间相互转化关系如下图所示:(部分反应物、生成物没有列出)
已知:A中含二种阳离子和一种带二个单位负电荷的阴离子,三种离子的个数比为3:1:3。阴离子中各元素的质量分数与C相同且式量是C的2倍。C、D都为气体且含有元素种类相同,C能使澄清石灰水变浑,E是一种红棕色的颜料,F的焰色反应呈紫色,I能使苯酚溶液显紫色。 回答下列问题: (1)C的电子式
。 (2)A的化学式
。 (3)D+E→C+G的方程式
。 (4)H+H2O2→I的离子反应方程式
。 (5)在A的溶液中滴入酸性高锰酸钾溶液,高锰酸钾溶液紫色褪去,而在A的溶液中滴入硫氰化钾溶液,溶液呈红色。产生上述现象的主要原因是
。 五、(本题包括1小题,10分) 试题详情
21、(10分)随着纳米技术的飞速发展,四氧化三铁纳米颗粒在磁性记录、磁流体、吸波、催化、医药等领域有着广泛的应用。“共沉淀法”是制备四氧化三铁纳米颗粒的常见方法,具体步骤为:将一定量的FeCl2?4H2O和FeCl3?6H2O制成混合溶液加入到烧瓶中,在N2气氛下,滴加氨水、搅拌、水浴恒温至混合液由橙红色逐渐变成黑色,继续搅拌15
min,磁铁分离磁性颗粒,用蒸馏水洗去表面残留的电解质,60℃真空干燥并研磨,可得直径约10 nm Fe3O4磁性颗粒。 (1)“共沉淀法”中N2的作用是______________,制备的总离子反应方程式为___________________。 (2)在医药领域,四氧化三铁纳米颗粒经表面活性剂修饰后,被成功制成磁性液体,又称磁流体(见图a)。磁流体属于__________分散系,负载药物后通过静脉注射或动脉注射进入人体,利用四氧化三铁具有_____________功能,在外界磁场的作用下,富集于肿瘤部位,当外磁场交变时,可控释药。 试题详情
试题详情
(3)科学研究表明,Fe3O4是由Fe2+、Fe3+、O2-通过离子键而组成的复杂离子晶体。O2-的重复排列方式如图b所示,该排列方式中存在着两种类型的由O2-围成的空隙,如1、3、6、7的O2-围成的空隙和3、6、7、8、9、12的O2-围成的空隙,前者为正四面体空隙,后者为正八面体空隙,Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则Fe3O4晶体中,正四面体空隙数与O2-数之比为_______,其中有______%正四面体空隙填有Fe3+,有________%正八面体空隙没有被填充。 六、(本题包括2小题,共18分) 试题详情
22.(8分)近日,油炸薯条再次出现食品安全危机,因为其中反式脂肪酸(trans fatty acids简称TFA)的含量增加了1/3。中国食疗网发布“反式脂肪酸预警报告”,报告称:摄入过多的反式脂肪酸,容易堵塞血管而导致心脑血管疾病。顺式脂肪酸、反式脂肪酸的结构如图所示。 试题详情

试回答下列问题: (1)顺(反)式脂肪酸中所含官能团名称是
(任填一种)。 (2)上述顺式脂肪酸和反式脂肪酸都能与H2在一定条件下发生氢化反应,其产物关系为 。 A.同分异构体 B.同系物 C.同一种物质 D.同素异形体 (3)研究表明,在特定的条件下,顺式脂肪酸与反式脂肪酸会产生互变,油脂长时间高温加热及油脂催化加氢都会使反式脂肪酸的含量增高。亚油酸(9,12-十八碳二烯酸)与氢气以1∶1催化加氢过程中,考虑顺、反异构,生成的脂肪酸最多有
种。 试题详情
(4)据专家介绍,多食用花生油对人体有益,是因为花生油中含反式脂肪酸较少,且含有对人体有益的白藜芦醇(化学名称为芪三酚),其结构简式为: 试写出1mol白藜芦醇与足量溴水发生反应的化学方程式:
。 试题详情
23.(10分)据《中国制药》报道,化合物C是用于合成抗“非典”药品(盐酸祛炎痛)的中间体,其合成路线为: 试题详情
试题详情
已知: (1)写出下列物质的结构简式:B
,C
(反应②产物HCl中的H元素来自于氨基)。 (2)A→D的转化中涉及的反应类型有
。(填字母序号) A、加成 B、取代 C、聚合 D、氧化 E、还原 (3)反应①②③中属于取代反应的是
。(填数字序号) (4)请你设计由甲苯→…→E的反应流程图(有机物用结构简式表示,必须注明反应条件),请在答题纸的方框中表示。 试题详情
  提示:①合成过程中无机试剂任选 ②反应流程图表示方法示例如下: 提示:①合成过程中无机试剂任选 ②反应流程图表示方法示例如下:
甲苯
……
E 七、(本题包括2小题,共18分) 试题详情
24.2007年3月8日媒体报道了陕西肯德基连锁店在煎炸油中添加滤油粉的情况,经卫生部门检测滤油粉实质为食品级三硅酸镁。三硅酸镁为白色无味粉末,不溶于水和乙醇,易与无机酸反应。某化学兴趣小组测定三硅酸镁的化学式(可用MgxSi3Oy?mH2O表示)。实验步骤如下: 试题详情
步骤一:取16.6 g三硅酸镁样品,充分加热至不再分解为止,冷却、称量,得固体13.0 g。 试题详情
步骤二:另取16.6g三硅酸镁搅拌中加足量4 mol/L盐酸100 mL,充分反应后,过滤,洗涤,烘干得固体9.0 g。该固体为空间网状结构且熔沸点很高。有关部门规定三硅酸镁样品中含水量12.2
%为优良级。 则:(1)计算确定MgxSi3Oy?mH2O的化学式。 (2)该小组测定的三硅酸镁样品是否为优良级? (3)写出该三硅酸镁样品与盐酸反应的化学方程式。 试题详情
25.石油化工是江苏省的支柱产业之一,为我省的经济发展作出了贡献。乙烯是石油化工中的重要物质,它主要通过石油产品裂解获得。 (1)石油产品裂解所得裂解气的平均组成可表示为CnHm(m>2n),经测定某裂解气中各气体的体积分数分别为:甲烷:4%、乙烯:50%、丙烯:10%、其余为丁二烯和氢气(气体体积均在同温同压下测定)。若得到50 mol乙烯,x mol丁二烯和y mol氢气。则x+y= , n / m = (请用含x的式子表示)。 (2)某化工厂每天由石油产品裂解得到乙烯56吨。再以乙烯为主要原料生产醋酸乙烯酯,醋酸乙烯酯是合成维尼纶的重要单体。生产原理如下: 试题详情
试题详情
反应①中乙烯的利用率为80%,反应②中乙醛的利用率为83.33%,反应③中乙酸与乙烯的利用率均为85%。则该厂每天最多可制得醋酸乙烯酯多少吨? 扬州市2006-2007学年度高三第二学期调研测试 试题详情
说明:1、文字简答题以关键词到位为准,按点给分; 2、化学用语书写:(1)方程式未配平不得分、无条件扣一半分值;
(2)化学式书写错误得0分; 3、写名称或化学式正确的正常给分; 4、其他合理解法正常给分。 第Ⅰ卷(选择题,共64分) 一、二:选择题 题 号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 答 案 B A C D D B A C AD AC C B AD B CD D 第Ⅱ卷(非选择题 共86分) 三、(共2小题,22分) 17.(8分) (1)ABDC(2分)(颠倒不得分) (2)左(1分),
继续往左盘小烧杯中慢慢加少量样品,使指针指向标尺中间,直至天平平衡(1分) (3)引流(1分) 防止液体局部过热,液滴溅出(1分) (4)沉淀后静置,向上层清液中加入CaCl2溶液,观察是否有沉淀生成,若无沉淀生成,则说明沉淀完全,反之则沉淀不完全。(1分)取最后一次洗涤液少许,滴入数滴K2CO3溶液(或AgNO3溶液等也可),若无沉淀产生,即沉淀洗涤干净。(1分) 18(共14分) (1)分液漏斗(1分)。Cu+4H++2NO3―=Cu2++2NO2↑+2H2O(或NO的方程式也可)(2分)。 (2)安全瓶(防止倒吸等)(1分) (3)①坩埚(1分) ②b(1分) ③Cu+H2O2+2H+=Cu2++2H2O(2分) ④防止双氧水分解(1分),酒精与水互溶且极易挥发,减少晶体溶解(1分),第二组(2分) 理由:第一组中的方案1需要加热,消耗能源,方案2所得产品含有铁元素杂质。而第二组方案几乎不产生有害气体,且所得产品纯度较高。(2分) 四、(共2小题,18分) 19、(8分)(1)三角锥型、平面三角形、四面体(一个1分,共3分) (2)H2O2、C2H6、CH3NH2、N2H4(H2N―NH2)(各1分,共2分,任写2种),O22―(1分)
高温 20、(10分)(1) (2分) (2)K3Fe(C2O4)3 (2分)(3)3CO+Fe2O3===2Fe+3CO2(2分) (2分) (2)K3Fe(C2O4)3 (2分)(3)3CO+Fe2O3===2Fe+3CO2(2分) (4)2Fe2++H2O2+2H+=2Fe3++2H2O(2分) (5)因为溶液中的草酸根被高锰酸钾氧化,溶液中的Fe3+与SCN―离子反应。(2分) 五、(1小题,共10分) 21(10分)(1)防止Fe2+被氧化(2分) Fe2++2Fe3++8NH3?H2O=Fe3O4↓+8NH4++4H2O(2分) (2)胶体(2分) 吸附(1分)(3)2:1 (1分) 12.5%(1分)
50%(1分) 六、(共2小题,18分) 22、(8分)(1)碳碳双键或羧基任写一种(2分) (2)C(2分)
(3)
4种(2分) (4) (2分) (2分) 23、(10分)(1)B: (1分) C: (1分) C: (1分) (1分) (2)BDE(2分,对1个给1分,对3个给2分。错1个扣1分,扣完为止) (3)①②(2分) (4)(每步1分,共4分,若2、3步颠倒则仅给2分) 
七、(共2小题,18分) 24.(8分)(1)9.0 g SiO2的物质的量为0.15 mol, 样品中H2O的质量为16.6 g-13.0 g= 3.6 g ,物质的量为0.02 mol
(1分) 设16.6 g 三硅酸镁的物质的量为a MgxSi3Oy?mH2O
~ 3SiO2
~ mH2O 1
3
m a
0.15 mol 0.02
mol a = 0.05 mol m = 4
(2分) MgxSi3Oy?mH2O的摩尔质量为   24x+28×3+16y+18×4= 332 24x+28×3+16y+18×4= 332
2x+4×3=2y 解之得:x=2 ,y=8
(2分) 三硅酸镁的化学式为Mg2Si3O8?4H2O (2)样品中含水量21.7%大于12.2% , 故样品不是优良级。 (1分) (3)Mg2Si3O8?4H2O+4HCl=2MgCl2+3H2SiO3↓+3H2O (2分) 25.(10分)(1)36 (2分) (2分) (2分) (2)设转化为乙酸的乙烯物质的量为x,与乙酸反应的物质的量为y  2x=3y (2分) 2x=3y (2分) 设每天可生成醋酸乙烯酯的物质为m t CH2=CH2~CH3COOCH=CH2
28
86
 m
(2分) m = 58.5 t
(2分) m
(2分) m = 58.5 t
(2分)
| | | 
 ”(读音为伦)。下列说法正确的是
”(读音为伦)。下列说法正确的是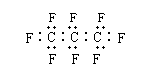 3.最近美国宇航局(NASA)公布:找到一种比二氧化碳效率高104倍的“超级温室气体”―全氟丙烷(C
3.最近美国宇航局(NASA)公布:找到一种比二氧化碳效率高104倍的“超级温室气体”―全氟丙烷(C


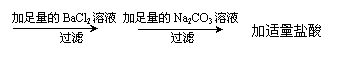
 B、
B、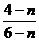 C、
C、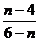 D、
D、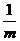
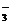
 H3O++S2―
H3O++S2―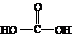 ),原碳酸的化学式为H4CO4(
),原碳酸的化学式为H4CO4(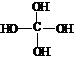 ),据此可推知,下列结构简式中属于原甲酸乙酯的是
),据此可推知,下列结构简式中属于原甲酸乙酯的是  14.3-甲基香豆素有香草味,可用于香料及化妆品,其结构简式为
。关于它
14.3-甲基香豆素有香草味,可用于香料及化妆品,其结构简式为
。关于它