|
试题详情
 13、下列方法能使电离平衡 13、下列方法能使电离平衡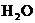  向右移动,且使溶液呈酸性的是 向右移动,且使溶液呈酸性的是
A、向水中加入少量硫酸氢钠固体 B、向水中加入少量硫酸铝固体 C、向水中加入少量碳酸钠固体 D、将水加热到100℃,使水的pH=6 试题详情
14.已知反应:①101kPa时,2C(s)+O2(g)=2CO(g )△H= ―221kJ?mol-1 试题详情
②稀溶液中,H+(aq)+OH-(aq)=H2O(1)H=-57.3kJ?mol-1 下列结论正确的是 试题详情
A、碳的燃烧热大于110.5kJ?mol-1 B、①的反应热为221 kJ?mol-1 试题详情
C、稀硫酸与稀NaOH溶液反应的中和热为―57.3 kJ?mol-1 试题详情
D、NaOH溶液反应生成1 mol水,放出57.3 kJ热量 试题详情
15.在一定条件下的固定容器中,当下列物理量不发生变化时,表明反应 试题详情
 A(s)+2B(g) C(g)+D(g),已达到平衡状态的是 : A(s)+2B(g) C(g)+D(g),已达到平衡状态的是 :
A、混合气体的压强
B、混合气体的密度 C、B 物质的量浓度
D、气体的总物质的量 试题详情
 16.可逆反应3X(g) 3Y(?)+Z(?);△H>0,升高温度时,气体的平均相对分子质量变小。下列说法不正确的是 16.可逆反应3X(g) 3Y(?)+Z(?);△H>0,升高温度时,气体的平均相对分子质量变小。下列说法不正确的是
A、若Z 为固体,则Y 一定是气体 B 、Y 、Z可能都是气体 C、 Y 、Z不可能都是固体或液体
D、Y 、Z一定是气体 试题详情
 17、在密闭容器中发生如下反应mA(g)+nB(g) pc(g),达到平衡后,保持温度不变,将气体体积缩小到原来的二分之一,当达到新平衡时,C的浓度为原来的1.9倍,下列说法正确的是 17、在密闭容器中发生如下反应mA(g)+nB(g) pc(g),达到平衡后,保持温度不变,将气体体积缩小到原来的二分之一,当达到新平衡时,C的浓度为原来的1.9倍,下列说法正确的是
A、m+n>p
B、平衡向逆方向移动 C、A的转化率提高
D、C的体积分数增加 试题详情
试题详情
A、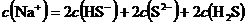 试题详情
B、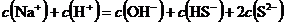 试题详情
C、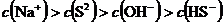 试题详情
D、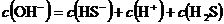 试题详情
19、下列各溶液中,微粒的物质的量浓度关系正确的是 试题详情
A、0.1mol/L的 溶液中: 溶液中: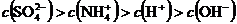 试题详情
B、0.1mol/L的 溶液中: 溶液中: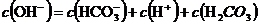 试题详情
试题详情
试题详情
20、用Pt作电极,电解串联电路中分装在甲、乙两个烧杯中的200mL0.3mol?L-1的 溶液和300mL0.2mol?L-1的AgNO3溶液,当电解产生0.56L(标准状况)Cl2时停止电解,取出电极,将两杯溶液混合,混合液的pH为(设混合后总体积为500mL) 溶液和300mL0.2mol?L-1的AgNO3溶液,当电解产生0.56L(标准状况)Cl2时停止电解,取出电极,将两杯溶液混合,混合液的pH为(设混合后总体积为500mL) 试题详情
A、1.4
B、5.6 C、7 D、12.6 得分 评卷人 试题详情
三、填空题(34分) 21、(2分)已知下列两个反应: a.C2H2( g )+ H2(
g )→C2H4( g ) △H<0 b. 2CH4( g )→C2H4(
g ) + 2H2( g ) △H>0 试题详情
判断以下3个热化学方程式 由大到小的顺序是
。 由大到小的顺序是
。 ①C(s)+2H2(
g )→CH4( g )
△H1 试题详情
②C(s)+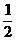 H2( g )→ H2( g )→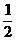 C2H2( g ) △H2 C2H2( g ) △H2 试题详情
③C(s)+ H2( g )→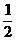 C2H4( g ) △H3 C2H4( g ) △H3 试题详情
22、(4分)某可溶性盐的化学式为 将一定量的该盐溶于水中。 将一定量的该盐溶于水中。 (1)若测得溶液pH=3,则该盐与水反应的离子方程式为(用X、Y、m、n表示) (2)若测得该盐溶液pH=11,则该盐与水反应的离子方程式为
试题详情
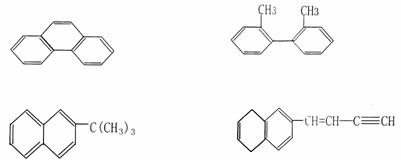
23、(7分)(1)按官能团的不同,可以对有机物进行分类,请指出下列有机物的种类。 试题详情
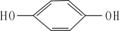 ;
;
试题详情
试题详情
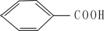  (2) (2)
所含官能团的名称是
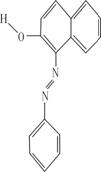
; 苏丹黄[1―(苯基偶氮)基―2―萘酚]的结构如右图,则其分子式为
。 试题详情
 CH3 CH3
试题详情
  (3)有机物CH3―CH2―C―CH―CH3的名称:
。 (3)有机物CH3―CH2―C―CH―CH3的名称:
。
CH3C2H5 (4)用一种试剂鉴别苯、四氯化碳、苯乙烯、乙醇四种物质,所选用的试剂的名称
,有关的化学反应方程式
。 试题详情
24、(9分)如图装置闭合电键时,电流计的指针将发生偏转。试回答下列问题。 试题详情
 (1)A、B两池及各电极的名称:A ,B ,Zn ,Pt 。 (1)A、B两池及各电极的名称:A ,B ,Zn ,Pt 。
(2)写电极反应式:Cu极:
,Pt极
。 试题详情
(3)如果电解质溶液仍为 溶液,将B中两极都换成铜电极,则工作一段时间后深液的颜色 。(填“加深”“变浅”或“无变化”)。 溶液,将B中两极都换成铜电极,则工作一段时间后深液的颜色 。(填“加深”“变浅”或“无变化”)。 试题详情
(4)如果电极材料不变,将B中 溶液换成 溶液换成 溶液,工作一段时间后A中溶液pH ,B中溶液pH (填“增大”“减小”或“不变”)。 溶液,工作一段时间后A中溶液pH ,B中溶液pH (填“增大”“减小”或“不变”)。 试题详情
25、(5分)在一定体积的密闭容器中,进行化学反应CO2(g)+H2(g)
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表,完成下列问题: 试题详情
 t℃ t℃
700 800 830 1000 1200 K 试题详情
试题详情
试题详情
试题详情
试题详情
2.6 (1)该反应的化学平衡常数表达式为K=
。 (2)该反应为
反应。(选填“吸热”或“放热”) (3)能判断该反应是否达到化学平衡状态的依据是
。 a. 容器中压强不变
b.混合气体中c(CO)不变 c.v正(H2)=v逆(H2O)
d. c(CO2)=c(CO) (4)某温度下,平衡浓度符合下式:c(CO2)?c(H2)=c(CO2)?c(H2O)。可判断此时的温度为
℃。 试题详情
 26、(7分)T℃时,有甲、乙两个密闭容器,4min时甲容器的体积为1L,乙容器的体积为2L,分别向甲、乙两容器中 加入6molA和3molB,发生了如下反应:3A(g)+bB(g)
3C(g)+2D(g)△H<0后,4min时甲容器内的反应 达到化学平衡,A 的浓度为2.4mol?L-1,B的浓度为1.8mol?L-1;t min后乙容器达到化学平衡,B 的浓度为0.8 mol?L-1
。根据题目给的信息完成下列问题: 26、(7分)T℃时,有甲、乙两个密闭容器,4min时甲容器的体积为1L,乙容器的体积为2L,分别向甲、乙两容器中 加入6molA和3molB,发生了如下反应:3A(g)+bB(g)
3C(g)+2D(g)△H<0后,4min时甲容器内的反应 达到化学平衡,A 的浓度为2.4mol?L-1,B的浓度为1.8mol?L-1;t min后乙容器达到化学平衡,B 的浓度为0.8 mol?L-1
。根据题目给的信息完成下列问题:
(1)甲容器中反应的平均速率v(B)=
,化学方程式中计量数b= 。 (2)乙容器中反应达到平衡所需要的时间t
(填“大于”“小于”或“等于”)4min,原因是
。 试题详情
(3)T℃时,在另一个体积与乙容器相同的丙容器中,为了使达到平衡时B的浓度仍然为0.8 mol?L-1,起始时,向容器中加入C、D的物质的量分别为3mol、2mol,则还需加入A、B的物质的量分别是
、
。 (4)若要使甲、乙两容器中B的平衡浓度相等,可以采取的措施是
。 A、保持温度不变,增大甲容器的体积至2L B、保持容器体积不变,使甲容器降低温度 C、保持容器压强和温度都不变,向甲中加入一定量的A气体 D、保持容器压强不变,向甲中加入一定量的B气体 得分 评卷人 试题详情
四、计算题(11分) 27、(5分)在1L含0.001 mol?L-1SO42-的溶液中,注入0.01
mol?L-1BaCl2溶液,能否使SO42-沉淀完全?[已知Ksp(Ba
SO4)=1.08×10-10] 试题详情
 28、(6分)在高温时HI分解的化学方程式为2HI(g) H2(g)+I2(g)向一体积为1L的密闭容器中装入2molHI,在440℃时反应达到化学平衡,其平衡常数K=2×10-2,求此时HI的分解率。 28、(6分)在高温时HI分解的化学方程式为2HI(g) H2(g)+I2(g)向一体积为1L的密闭容器中装入2molHI,在440℃时反应达到化学平衡,其平衡常数K=2×10-2,求此时HI的分解率。
试题详情
一、选择题(共10分) 1、C 2、D 3、C 4、A 5、B 二、选择题(共45分) 6、C 7、C 8、B 9、B 10、C
11、D 12、C 13、B 14、A 15、C
16、D 17、B 18、D 19、C 20、C 三、填空题(共34分) 21、(2分) △H1<△H3<△H2
-(m-1)  (2)Ym-+H2O HY +OH- (2)Ym-+H2O HY +OH-
23、(7分)(1)酚 酯 (2)羧基 C16H12ON2
(3)3.3.4―三甲基己烷 
24、(9分)(1)A 原电池,B电解池,Zn负极,Pt阳极 (2)2H++2e- =H2↑ 4OH--4e- =2H2O+O2↑ (3)无变化 (4)增大,增大 25、(5分)(1)K= (2)吸热 (3)b、c (4)830 26、(7分)(1)0.3 mol?L-1min1 (2)1 (3)3mol 2 mol (4)A、B 四、计算题(11分) 27、(5分)能使SO42-离子沉淀完全
28、(6分)αHI=22%
| | | 
 2007――2008学年度上学期期末检测
2007――2008学年度上学期期末检测 B、
B、
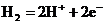 D、
D、
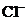 、
、 、
、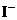 ,当逐滴加入AgNO3溶液时,沉淀先后出现的顺序是
,当逐滴加入AgNO3溶液时,沉淀先后出现的顺序是
 7、某烯烃与H2加成后的产物是CH3―CH―CH―CH(CH3)2,则该烯烃的结构式可能有
CH3 CH3
7、某烯烃与H2加成后的产物是CH3―CH―CH―CH(CH3)2,则该烯烃的结构式可能有
CH3 CH3 ,则该溶液中的溶质可能是
,则该溶液中的溶质可能是 B、
B、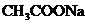 C、
C、 D、
D、
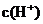 相同
相同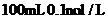 的两溶液能中和等物质的量的氢氧化钠
的两溶液能中和等物质的量的氢氧化钠 的两溶液稀释100倍,
的两溶液稀释100倍, 都为5
都为5 均明显减小
均明显减小 =
=