
浙江省杭绍金温衢七校2008学年高一第二学期期中联考试卷
化学
考试时间:90分钟 总 分:100分
可能用到的相对原子质量
H:1 B:
第Ⅰ卷
一、选择题(每小题只有一个正确答案,每题2分,共48分)
1.19世纪中叶,门捷列夫的突出贡献是
A.提出原子学说 B.发现元素周期表 C.提出分子学说 D.发现氧气
2.下列关于元素周期表的认识中,其中不正确的是
A.元素周期表有18个族 B.元素周期表有七个周期
C.元素原子的电子层数等于其所在周期的周期序数
D.主族元素原子的最外层电子数等于其所在族的族序数
3.下列化合物中阴离子半径和阳离子半径之比最大的是
A.LiI B.NaBr C.KCl D.CsF
4.铋是氮族元素中原子序数最大的元素,试推测铋单质或其化合物可能具有的性质
A.铋能形成很稳定的气态氢化物
B.铋的最高价氧化物对应水化物的酸性比磷酸强
C.铋单质可能具有良好的导电性并具有较大的密度
D.铋的最高价氧化物是Bi2O3
5.下列物质既能与盐酸反应,又能与烧碱溶液反应的是
① Al2O3 ②Al(OH)3 ③Al ④NaHCO3 ⑤NaHS ⑥CaCO3 ⑦NaHSO4 ⑧NaHSO3
A、除⑥外 B、除⑥、⑦、⑧外
C、除⑥、⑦外 D、除①、②、③、④、⑤外
6.100ml 18mol/L的浓硫酸中加入过量铜片,加热使之反应,则被还原的硫酸为
A、 1.8mol B 、0.9mol C、大于0.9 mol D、 小于0.9mol
7.已知:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;
②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;
③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色。
下列判断正确的是
A 上述实验证明氧化性:MnO4->Cl2>Fe3+>I2
B 上述实验中,共有两个氧化还原反应
C 实验①生成的气体不能使湿润的淀粉KI试纸变蓝
D 实验②证明Fe2+既有氧化性又有还原性
8.设阿伏加德罗常数为NA,下列说法正确的是
A.1 mol Cl2与足量Fe反应,转移的电子数为3NA
B.
C.1 mol的NO2和N2O4混合气体中含有的原子数为3NA
D.在
9.下列各组原子序数所表示的两种元素,能形成AB2型离子化合物的是
A.11和16 B.12和
10.以下对元素的性质判断正确的是
A.元素的最高价氧化物的水化物碱性越强,该元素的金属性就越强
B.元素的气态氢化物的水溶液酸性越强,该元素的非金属性就越强
C.元素的单质和水的反应越剧烈,该元素的非金属性就越强
D.元素的单质越容易和氢气化合,该元素的金属性就越强
11.下列各组顺序的排列不正确的是
A.原子半径:Na<Mg<Al B.热稳定性:HCl>H2S>PH3
C.酸性强弱:H2SiO4<H2CO3<H3PO4 D.熔点:NaCl>Na>CO2
12.下列固体或分子中,含有化学键类型有差异的一组是
A. H2O、CO2 B.MgF2、H2O
13.某元素X的气态氢化物的化学式为H2X,则X的最高价氧化物的水化物的化学式为A.H2XO3 B.HXO
14.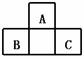 A、B、C均为短周期元素,它们在周期表中的位置如右图.已知B、C两元素在周期表中族序数之和是A元素族序数的2倍;B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C 所在的一组是
A、B、C均为短周期元素,它们在周期表中的位置如右图.已知B、C两元素在周期表中族序数之和是A元素族序数的2倍;B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C 所在的一组是
A.Be、Na、Al B.B、Mg、Si C.O、P、Cl D. C、Al、P
15.想一想:Ba(OH)2(固态)、CuSO4(固态)、CH3COOH(液态)这些物质为什么归为一类,下列哪个物质还可以和它们归为一类
A.75%的酒精溶液 B.硝酸钠 C.Fe(OH)3胶体 D.豆浆
16.下列溶液中C(Cl―)与1 mol?L―1的AlCl3溶液中C(Cl―)相等的是
A.3 mol?L―1的KClO3溶液750mL
B.标准状况下
C.0.1mol?L―1的FeCl3溶液
D.将
17.在化学反应A(g)+3B(g) 
18.下列变化中,一定不存在化学能与热能相互转化的是?
A.铝热反应 B.镁条与盐酸反应 C.燃放爆竹 D.干冰气化
19.已知:在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气,放出484kJ热量。下列热化学方程式正确的是
A.H2O(g)=H2(g)+1/2O2(g) ΔH=+242kJ?mol-1
B.2H2(g)+O2(g)=2H2O(l) ΔH=-484kJ?mol-
D.2H2(g)+O2(g)=2H2O(g) ΔH=+484kJ?mol-1
20.可逆反应2SO2 + O2  2SO3达到平衡的标志是
2SO3达到平衡的标志是
① 消耗2 mol SO2的同时生成2 mol SO3
② SO2、O2与SO3的物质的量之比为2∶1∶2
③ 反应混合物中,SO3的质量分数不再改变
A.①② B.①③ C.只有③ D.只有①
21.将下列晶体熔化:氢氧化钠、金刚石、硫化钾、干冰,需要克服的微粒间的相互作用
①共价键 ②离子键 ③分子间作用力,正确的顺序是( )
A.①②②③ B.②①②③ C.②③②① D.①①②③
22.A和M为两种元素,已知A位于短周期,且M―与A2+的电子数之差为8,则下列说法正确的是
A.A和M的原子序数之差为6 B.A和M原子的最外层电子数之和为9
C.A和M原子最外层电子数之差为7 D、A和M原子的电子总数之和可能为11
23.某溶液与Al反应能放出H2,下列离子在该溶液中一定能大量共存的是
A.NH4+、Fe2+、NO3-、SO42- B.Na+、K+、Cl-、SO42-
C.Mg2+、H+、Cl-、NO3- D.K+、Ca2+、HCO3-、Cl-
24.今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+ 、Mg2+、Ba2+、Cl-、CO32 -、SO42 -,现取三份100 mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04 mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀
A.K+一定存在 B.100 mL溶液中含0.01 mol CO32 -
C.Cl-可能存在 D.Ba2+一定不存在,Mg2+一定存在
第Ⅱ卷
二.填空题(40分)
25.(7分)基本知识点考查
(1)写出下列物质或微粒的电子式:
①氖原子 ②钾离子 ③硫离子
(2)用电子式表示:二氧化碳_________________溴化镁_______________
(3)画出下列各微粒的结构示意图:
①与Ne原子电子层结构相同的-2价阴离子的离子结构示意图 ;
②质量数为23,中子数为12的原子的原子结构示意图 。
26.(15分)下表为元素周期表的一部分,用元素符号或化学式回答下列问题。
主族
周期
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
2
⑥
⑦
3
①
③
⑤
⑧
⑩
4
②
④
⑨
(1)10种元素中,化学性质最不活泼的是 ,除⑩外原子半径最大的是 。
(2)①②⑤三种元素最高价氧化物对应的水化物碱性最强的是
(3)①②③④⑤⑧六种元素形成的离子半径之中最大的是 最小的是
(4)元素⑦的氢化物的化学式为 ;该氢化物和元素②单质反应的化学方程式为 。
(5)①⑨形成的化合物灼烧时火焰焰色为 ;该化合物的溶液与元素⑧的单质反应的化学方程式为 。
(6)③的单质在⑥⑦形成化合物中燃烧的化学方程式为 ;单质⑤的氧化物与②的最高价氧化物对应水化物溶液反应的离子方程式为 。
27.(4分)A、B两元素,A的原子序数为x,A和B所在周期包含元素种类数目分别为m和n。如果A和B同在ⅠA族,当B在A的上一周期时,B的原子序数为 ,当B在A的下一周期时,B的原子序数为 ;如果A和B同在ⅦA族,当B在A在上一周期时,B的原子序数为 ;当B在A的下一周期时,B的原子序数为 。
28.(4分)用5mol?L-1的NaOH溶液配制0.1mol?L-1250mLNaOH溶液的过程为:用10mL量筒量取5mol?L-1的NaOH溶液5mL,加入盛有适量蒸馏水的烧杯中,用玻璃棒搅拌使其稀释;再将烧杯中的溶液注入
,并用少量蒸馏水洗涤
2-3次,洗涤液也注入容量瓶;轻轻晃动
,使溶液混合均匀;将蒸馏水注入容量瓶,液面离容量瓶刻度线以下1―
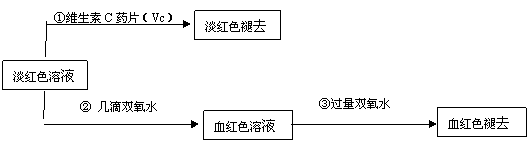
29.(10分)“速力菲”是一种人工合成的补铁剂,某研究性学习小组为探究其主要成分,进行了如下实验:
(1)打开这种药片的密封膜,发现其外观为淡黄色;
(2)将“速力菲”投入小试管中,加入少量蒸馏水,充分振荡后发现溶液变浑浊;慢慢加入稀硫酸后溶液变得澄清透明并显黄色;滴加KSCN溶液,立即变为血红色。学生甲由此断定“速力菲”的主要成分是三价铁盐;
(3)学生乙的操作与甲大致相同,所不同的是他动作敏捷,且在振荡前用橡皮塞塞紧试管口。结果发现:溶液仅显示淡红色。乙同学认为“速力菲”的主要成分不是三价铁盐而是亚铁盐。
(4)为了确认甲、乙的结论是否正确,学生丙将乙所得的淡红色溶液分成两份继续进行实验:
 |
试回答下列问题:
(1)甲、乙两位同学的结论中比较合理的是 ,另一同学判断出错的原因是 。
(2)丙的实验①说明维生素C具有较强的 性(填“氧化”或“还原”)。
(3)写出与丙的实验②中现象对应的离子反应方程式 ;______________________________________
(4)关于丙的实验③中的现象,丙同学提出了两种假设:一种是过量的双氧水与Fe3+结合生成了某种稳定的新物质;另一种则是过量的双氧水将SCN-氧化了。请你设计一个实验方案以确认哪种假设更合理
。
(5)针对实验目的,本次实验尚未完成的任务是 。
三.计算题(12分)
30.(4分)有100毫升 12 mol?L-1的盐酸溶液。求:
(1)该溶液中氢离子的物质的量浓度为__ __mol∙L-1。
(2)该溶液中相当于溶解了标准状况下__ __L的HCl气体。
31.(8分)在一体积固定的密闭容器中加入反应物A、B,发生如下反应:
A + 3B ==
(1)2min 末B、C的浓度。
(2)以单位时间内B的浓度的减小和C的浓度的增加来表示2min 内该反应的平均速率。
 杭绍金温衢七校2008学年第二学期期中联考答题卷
杭绍金温衢七校2008学年第二学期期中联考答题卷
高一化学
座位号:
第Ⅱ卷
二.填空题(40分)
25.(7分)(1)①氖原子 ②钾离子 ③硫离子
(2)二氧化碳_________________溴化镁_______________
(3)①离子结构示意图 ;②原子结构示意图 。
26.(15分)(1) , 。
(2)
(3)
(4)化学式为 ; 。
(5) ; 。
(6) ; 。
27.(4分)B的原子序数为 ; B的原子序数为 ;
B的原子序数为 。
28.(4分) , , , ;
29.(10分)
(1) , 。
(2) 性。
(3) ;______________________________________
(4) 。
(5) 。
三.计算题(12分)
30.(4分)(1) (2)
31.(8分)解:
杭绍金温衢七校2008学年第二学期期中联考
一.选择题(48分)
1
2
3
4
5
6
7
8
9
10
11
12
B
A
A
D
C
D
A
D
B
A
B
B
13
14
15
16
17
18
19
20
21
22
23
24
D
C
B
B
A
D
A
C
B
B
B
A
25.(7分)略
26.(14分,每个方程式2分)
(1)Ar K (2 )KOH (3)Cl― Al3+
(4)H2O 2K+H2O==2KOH+H2↑
(5)黄 Cl2+2NaBr==2NaCl+Br2
点燃
(6)2Mg+CO2====2MgO+C
(7)Al2O3+2OH―====2AlO2―+H2O
27.(4分)x-8 x+18 x-18 x+8
28.(5分)250mL的容量瓶、烧杯内壁、容量瓶、胶头滴管、相切(各1分)
29.(10分,其中(3)4分,(4)2分,其余每空1分)
(1)乙 亚铁盐在空气中易被氧气氧化 (2) 还原
(3) 2Fe2++H2O2+2H+=2Fe3++2H2O Fe3++3SCN-=Fe(SCN)3 。
(4)再加过量KSCN,如果变血红色,则第二种合理;如果不变色,则第一种合理
(5) 未能测其成分。
三.计算题(12分)
30.(4分)(1)12 (2)27
31.(8分)(1)2min 末B的浓度为0.7mol?L-1 ,C的浓度为0.6mol?L-1 。
(2) 
 每个计算结果2分,本题共8分。
每个计算结果2分,本题共8分。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com