2008学年第一学期期中考查试题
高三化学
考生须知:
1.本卷试题分为第I卷、第II卷,满分100分,考试时间100分钟。
2.本卷答题时不得使用计算器,不得使用修正液(或涂改液)、修正带。
3.答题时将答案均填在答卷相应题号的位置,不按要求答题或答在草稿纸上无效。
4.可能用到的相对原子质量:H 1 C 12 O 16 Mg 24 Al 27 S 32 Fe 56 Cu 64
第I卷(选择题,共48分)
一.选择题(本题包括24小题,每小题2分,共48分。每小题只有一个选项符合题意。)
1.正确掌握化学用语和化学基本概念是学好化学的基础。下列各项中表达正确的是
试题详情

 A.NaCl的电子式:
A.NaCl的电子式:
试题详情
 B.H2O分子的分子结构模型示意图:
(三个原子在同一直线上)
B.H2O分子的分子结构模型示意图:
(三个原子在同一直线上)
C.CrO5的结构式为 ,该氧化物中Cr为+6价
D.次氯酸的结构式:H-Cl-O
试题详情
2.用右图表示的一些物质或概念间的从属关系中不正确的是
X
Y
试题详情
 Z
Z
A
苯的同系物
芳香烃
芳香族化合物
B
胶 体
分散系
混合物
C
电解质
离子化合物
化合物
D
碱性氧化物
金属氧化物
氧化物
试题详情
3.分类方法在化学学科的发展中起到了非常重要的作用。下列分类标准合理的是
①根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸等;
②根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应;
③根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液;
④根据反应中的热效应将化学反应分为放热反应和吸热反应
A.①② B.③④ C.①③ D.②④
试题详情
4.下列过程中,不涉及化学变化的是
A.蛋白质溶液加入CuSO4溶液产生沉淀 B.纸层析法分离Fe3+和Cu2+
C.淀粉遇碘变蓝 D.苯酚与FeCl3溶液显紫色
试题详情
5.13C―NMR(核磁共振)、15N―NMR可用于测定蛋白质、核酸等生物大分子的空间结构,KurtW ü
thrich等人为此获得2002年诺贝尔化学奖。下面有关13C、15N叙述正确的是
A.13C与15N有相同的中子数
B.13C与C60互为同素异形体
C.15N与14N互为同位素
D.15N的核外电子数与中子数相同
试题详情
6.某元素的原子最外层有2个电子,则这种元素是
A.金属元素 B.惰性气体元素
C.第二主族元素 D.以上叙述都可能
试题详情
7.NA表示阿伏加德罗常数,以下说法正确的是
A.18g金属铝由原子变为离子时失去的电子数为NA
B.在通常条件下,1mol氩气含有的原子数为2NA
试题详情
C.在标准状况下,2.24 L氨气所含的电子总数约为NA
D.含有NA个原子的镁在足量的二氧化碳气体中充分燃烧生成固体的质量为40g
试题详情
8.三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2。其反应原理为:
试题详情
C3N3(OH)3 3HNCO; 8HNCO+6NO2
3HNCO; 8HNCO+6NO2 7N2+8CO2+4H2O
7N2+8CO2+4H2O
下列说法正确的是
A.1 molNO2在反应中转移的电子为4mol B.HNCO是一种很强的氧化剂
C.C3N3(OH)3与HNCO为同一物质 D.反应中NO2是还原剂
试题详情
9.下列说法正确的是
A.同一条件下,不同物质的量浓度的氨水的电离程度是相同的
B.强电解质都是离子化合物,弱电解质都是共价化合物
C.反应能否自发进行与温度有关
试题详情
D.能自发进行的化学反应,一定是△H>0、△S>0
试题详情
10.已知aAn+、bB(n+1)+、cC n-、dD(n+1)- 均是由同周期主族元素形成的简单离子。下列叙述正确的是
A.原子序数:a>b>c>d
B.离子半径:D>C>A>B
C.原子半径:C>D>A>B
D.单质还原性:A>B>C>D
试题详情
11.已知三角锥形分子E和直线形分子G反应,生成两种直线形分子L和M(组成E、G、L、M分子的元素原子序数均小于10)如下图,则下列判断错误的是
试题详情
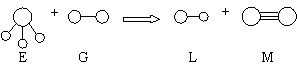
A.G是最活泼的非金属单质 B.L在水中不能完全电离
C.E能使紫色石蕊试液变蓝色 D.M化学性质活泼
试题详情
12.下列关于元素周期表和元素周期律的说法错误的是
A.Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多
B.第二周期元素从Li到F,非金属性逐渐增强
C.因为Na比K容易失去电子,所以Na比K的还原性强
D.O与S为同主族元素,且O比S的非金属性强
试题详情
13.下列说法正确的是
A.原子晶体中存在共价键,还可能存在离子键或氢键
B.稀有气体形成的晶体属于分子晶体
C.干冰升华时,分子内共价键会发生断裂
D.非金属元素之间形成的化合物一定是共价化合物
试题详情
14.在理论上不能用于设计原电池的化学反应是
A. HCl(aq)+NaOH(aq)=NaCl( aq )+H2O(l) △H<0
B. 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H<0
C. 4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)
△H<0
D. 2H2(g)+O2(g)=2H2O(l) △H<0
试题详情
15.用石墨作电极,电解1 mol/L下列物质的溶液,溶液的pH保持不变的是
A.HCl
B.NaOH
C.Na2SO4 D.NaCl
试题详情
16.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
试题详情
 ①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)
试题详情
△H=+49.0 kJ?mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g)
试题详情
△H=-192.9 kJ?mol-1
下列说法正确的是
试题详情
A.CH3OH的燃烧热为192.9 kJ?mol-1
B.反应①中的能量变化如右图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应:
试题详情
CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9 kJ?mol-1
试题详情
17.已知:①1g氢气完全燃烧生成水蒸气时放出热量121 kJ;②1molO2中的共价键完全断裂时吸收热量496 kJ;③H-O键的键能463kJ。则氢气中1molH-H键断裂时吸收热量为
A.920 kJ B.557 kJ C.436 kJ D.188 kJ
试题详情
18.下列事实不能用勒沙特列原理解释的是
A.氨水应密封保存
B.浓硫酸在加热条件下能与铜反应,而稀硫酸不能
C.合成氨生产过程中使用过量氮气以提高氢气的转化率
D.实验室常用排饱和食盐水的方法收集氯气
试题详情
19.下列各组离子在溶液中能大量共存的是
A.Na+、S2-、OH-、AlO2-
B.SO32-、NO3-、H+、K+
C.Fe2+、Cu2+、ClO-、S2- D.H+、Na+、SO42-、S2O32-
试题详情
20.设某盐酸的pH=x,氨水的pH=y,已知x+y=14,且y>11。将上述两溶液分别取等体积充分混合后,所得溶液中各离子浓度由大到小的顺序是
A.c(NH4+)>c(Cl-)>c(OH-)>c(H+) B.c(NH4+)>c (Cl-)>c(H+)>c(OH-)
C.c(Cl-)>c(NH4+)>c(OH-)>c(H+) D.c(Cl-)>c (NH4+)>c(H+)>c(OH-)
试题详情
21.常温下,纯水中存在电离平衡:H2O H++OH-。欲使水的电离平衡向正方向移动,并使c(H+)增大,应加入的物质是
H++OH-。欲使水的电离平衡向正方向移动,并使c(H+)增大,应加入的物质是
A.H2SO4
B.AlCl3 C.NaHCO3
D.NaOH
试题详情
22. 下列离子方程式书写正确的是
A.碳酸氢镁溶液中加入足量的石灰水
Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+MgCO3↓+2H2O
B.在碳酸氢钙溶液中加入少量苛性钾溶液:
Ca2++HCO3-+OH-=CaCO3↓+H2O
C.K2S溶液显碱性的原因:S2-+H2O=HS-+OH-,HS-+H2O=H2S+OH-
D.醋酸跟氢氧化钾溶液反应:H++OH―=H2O
试题详情
23.c1、c 2、α 1、α 2、pH1、pH2分别表示两种一元弱酸的物质的量浓度、电离度和溶液的pH。如果已知pH1>pH2,α l>α 2,则c1和c 2的关系
A.c1>c2 B.c1=c 2 C.c1<c 2
D.无法确定
试题详情
24.在某容积一定的密闭容器中,有下列的可逆反应:A(g)+B(g) xC(g) 有图I所示的反应曲线(T表示温度,P表示压强,C%表示C的体积分数)。试判断对图II的说法中正确的是
xC(g) 有图I所示的反应曲线(T表示温度,P表示压强,C%表示C的体积分数)。试判断对图II的说法中正确的是
试题详情
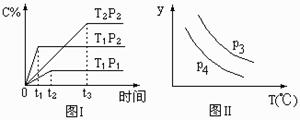
A.P3>P4,y轴表示B的百分含量 B.P3<P4,y轴表示B的体积分数
C.P3<P4,y轴表示混合气体的密度 D.P3>P4,y轴表示混合气体的平均摩尔质量
第II卷(共52分)
【考生注意】第25题分A、B两题,考生可任选一题。若两题均做,一律按A题计分。
试题详情
二.简答题(本大题包括5小题,共45分。)
25.(A题,8分)
(1)在上面元素周期表中画出金属元素与非金属元素的分界线。
(2)根据NaH的存在,有人提议可将氢元素放在VIIA族,那么根据其最高正价与最低负价的绝对值相等,又可将氢元素放在周期表中的
族。
(3)现有甲、乙两种元素,甲元素原子核外有三个电子层,最外层电子数比次外层少1;乙元素的焰色反应显黄色。
① 用元素符号将甲、乙两元素填写在上面元素周期表中对应位置。
② 甲元素与硫元素相比较,非金属性较强的是
(填名称),写出可以验证该结论的一个化学反应方程式
。
|
(1)在上面元素周期表中全部是金属元素的区域为 。 (2)有人认为形成化合物最多的元素不是IVA族的碳元素,而是另一种短周期元素,请你根据学过的化学知识判断这一元素是 (填元素符号)。 (3)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。 ①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。 ②甲、乙两元素相比较,金属性较强的是 (填名称),可以验证该结论的实验是
。 a.将在空气中放置已久的这两种元素的块状单质分别放入热水中 b.将这两种元素的单质粉末分别和同浓度的盐酸反应 c.将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液 d.比较这两种元素的气态氢化物的稳定性
试题详情
26.(6分)请完成下列各小题。 (1)配平下列离子反应方程式: Fe(OH)3+
ClO-+ OH-= FeO4n- + Cl-+ H2O 试题详情
(2)已知(1)中反应消耗3.21g Fe(OH)3时,共转移了5.418×1022个电子,则FeO4n-中Fe元素的化合价为
。 (3)根据(1)、(2)推测,FeO4n-能和下列
(填序号)物质反应 ①KMnO4 ②SO2 ③HI ④NaNO3 试题详情
试题详情
①0.1mol/L
NH4Cl
②0.1mol/L CH3COONH4 ③ 0.1mol/L NH4HSO4 试题详情
④0.1mol/L NH3?H2O和0.1mol/L
NH4Cl混合液 ⑤0.1mol/L NH3?H2O 请根据要求填写下列空白: (1)溶液①呈 性(填“酸”、“碱”或“中”),其原因是 (用离子方程式表示)。 (2)在上述五种溶液中,pH最小的是 ;c(NH4+)最小的是 ?填序号?。 (3)比较溶液②、③中c(NH4+)的大小关系是② ③?填“>”、“<”或“=”)。 试题详情
(4)在溶液④中, 离子的浓度为0.1mol/L;NH3?H2O和
离子的物质的量浓度之和为0.2 mol/L。 (5)常温下,测得溶液②的pH=7,则说明水解程度CH3COO- NH4+(填“>”、“<”或“=”,下同),CH3COO-与NH4+浓度的大小关系是:c(CH3COO-) c(NH4+)。 试题详情
28. (8分)将含有KBr、CuSO4、NaCl三种物质的水溶液(分别为1mol/L)用铂电极进行电解,且电解足够长一段时间。试回答: (1)最初阶段电解反应的离子方程式为
。 (2)按时间先后依次写出阳极上发生的所有电极反应 (用电极反应式表示)。 (3)电解过程中,电解液的颜色如何变化(假如溶液始终保持均匀)? 。 (4)最终溶液显 性。 试题详情
29.(14分)X、Y、Z是短周期元素的三种常见氧化物。X跟水反应后可生成一种具有还原性的不稳定的二元弱酸A;Y和X的组成元素相同;1mol Z在加热时跟水反应的产物B需要用6mol的氢氧化钠才能完全中和,在一定条件下,Y可以跟非金属单质C反应生成X和Z。请完成下列各小题: (1)二元弱酸A的化学式是 ;其与氯水反应的离子方程式为 。 (2)Y的化学式是 。 (3)B在水中的电离方程式为
。 (4)单质C是
,其形成的晶体属于
(填晶体类型),其与Y反应的化学方程式为
。 试题详情
三.计算题(本大题只有1题,共7分) 30.(7分)电子工业常用一定浓度的FeCl3溶液腐蚀敷有铜箔的绝缘板,制成印刷线路板。有关反应为:2FeCl3+Cu=2FeCl2+CuCl2。 试题详情
现将一块敷有铜箔的绝缘板浸入8.00×102 mL某FeCl3溶液A中,一段时间后,将该线路板取出,向所得溶液B中加入铁粉m g,充分反应后剩余固体n g;将固体滤出并从滤液C(忽略反应前后溶液体积变化)中取出20.00mL,向其中滴入3.00mol • L-1AgNO3溶液60.00 mL时,溶液中的Cl-恰好完全沉淀。请计算: (1)溶液A中FeCl3的物质的量浓度为___________________; (2)假若铁粉不再溶解,向溶液B中加入的铁粉质量至少应当大于________________; (3)讨论当剩余固体的组成不同时m与n可能的取值范围,并填入下表 剩余固体的组成 m的取值范围 n的取值范围 只有铜 有铁且有铜 (用含m的代数式表示) 试题详情
(4)当m=100.0,n=96.8时,溶液B中FeCl2的物质的量浓度为_________mol • L-1。 试题详情
  2008学年第一学期期中考查答题卷 2008学年第一学期期中考查答题卷
高三化学 第I卷(选择题,共48分) 题号 1 2 3 4 5 6 7 8 9 10 答案 题号 11 12 13 14 15 16 17 18 19 20 答案 题号 21 22 23 24 答案 第II卷(共52分) 【考生注意】第25题分A、B两题,考生可任选一题。若两题均做,一律按A题计分。 试题详情
二.简答题(本大题包括5小题,共45分。) 25.(A题,8分)(1)画出金属元素与非金属元素的分界线 (2) 族。 (3)①用元素符号将甲、乙两元素填写在上面元素周期表中对应位置。 ② (填名称),化学反应方程式
。 试题详情
25.(B题,8分)
A
B
C
D (1)全部是金属元素的区域为 。 (2)
(填元素符号)。 (3)①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。 ②金属性较强的是 (填名称),可以验证该结论的实验是
。
试题详情
26.(6分) (1) Fe(OH)3+
ClO-+ OH-= FeO4n- + Cl-+ H2O (2) 。 (3)
(填序号) 试题详情
27.(9分) (1) 性, (用离子方程式表示)。 (2)pH最小的是 ;c(NH4+)最小的是 ?填序号?。 (3)c(NH4+)的大小关系是② ③?填“>”、“<”或“=”)。 试题详情
(4)在溶液④中, 离子的浓度为0.1mol/L;NH3?H2O和
离子的物质的量浓度之和为0.2 mol/L。 (5)水解程度CH3COO- NH4+,浓度的大小关系是:c(CH3COO-) c(NH4+)。 试题详情
28. (8分) (1)最初阶段电解反应的离子方程式为
。 (2)
。 (3) 。 (4)最终溶液显 性。 试题详情
29.(14分) (1)A的化学式是 ;其与氯水反应的离子方程式为 。 (2)Y的化学式是
。 (3)B在水中的电离方程式为
。 (4)单质C是
,其形成的晶体属于
(填晶体类型),其与Y反应的化学方程式为
。 试题详情
三.计算题(本大题只有1题,共7分) 30.(7分)电子工业常用一定浓度的FeCl3溶液腐蚀敷有铜箔的绝缘板,制成印刷线路板。有关反应为:2FeCl3+Cu=2FeCl2+CuCl2。 试题详情
现将一块敷有铜箔的绝缘板浸入8.00×102
mL某FeCl3溶液A中,一段时间后,将该线路板取出,向所得溶液B中加入铁粉m g,充分反应后剩余固体n g;将固体滤出并从滤液C(忽略反应前后溶液体积变化)中取出20.00mL,向其中滴入3.00mol • L-1AgNO3溶液60.00 mL时,溶液中的Cl-恰好完全沉淀。请计算: (1)溶液A中FeCl3的物质的量浓度为
; (2)假若铁粉不再溶解,向溶液B中加入的铁粉质量至少应当大于_________________; (3)讨论当剩余固体的组成不同时m与n可能的取值范围,并填入下表 剩余固体的组成 m的取值范围 n的取值范围 只有铜 有铁且有铜 (用含m的代数式表示) 试题详情
(4)当m=100.0,n=96.8时,溶液B中FeCl2的物质的量浓度为
mol • L-1。 试题详情
高三化学 第I卷(选择题,共48分) 一.选择题(本题包括24小题,每小题2分,共48分。每小题只有一个选项符合题意。) 题号 1 2 3 4 5 6 7 8 9 10 答案 C C D B C D C A C B 题号 11 12 13 14 15 16 17 18 19 20 答案 D C B A C D C B A A 题号 21 22 23 24 答案 B B C D 第II卷(共52分) 二.简答题(本大题包括5小题,共45分。) 【考生注意】第25题分A、B两题,考生可任选一题。若两题均做,一律按A题计分。 25.(A题,8分)(1)画出金属元素与非金属元素的分界线(2分) Na Cl (2) IVA 族。(1分,其他答案均不给分) (3)①见表中“Na”和“Cl”(各1分,写成名称或位置写错均不给分)。 ② 氯
(填名称,1分),化学反应方程式 Cl2+H2S=2HCl+S(2分,其他合理答案也给分) 。 25.(B题,8分) Mg Al
A
B
C
D (1)全部是金属元素的区域为 B
。(1分) (2) H (1分,填元素符号)。 (3)①见表中“Mg”和“Al”(各1分,写成名称或位置写错均不给分)。 ②金属性较强的是 镁 (1分,填名称),实验是 b、c (全对3分,自选1个给1分,有错不给分)。 26.(6分,每小题2分,其中第(3)小题全对2分,自选1个给1分,有错不给分) (1) 2 Fe(OH)3+ 5-n ClO-+ 2n
OH-= 2 FeO4n-
+ 5-n Cl-+ n+3
H2O (2) +6 。 (3) ②③ (填序号) 27.(9分,每空1分) (1) 酸 性, NH4++H2O NH3?H2O+H+ (写成“=”不给分)。 NH3?H2O+H+ (写成“=”不给分)。 (2)pH最小的是 ③ ;c(NH4+)最小的是 ⑤ ?填序号?。 (3)c(NH4+)的大小关系是② < ③?写成“小于”不给分)。 (4)在溶液④中, Cl-(或“氯”)离子的浓度为0.1mol/L;NH3?H2O和NH4+(或“铵根”) 离子的物质的量浓度之和为0.2 mol/L。 (5)水解程度CH3COO- = NH4+,浓度的大小关系是:c(CH3COO-) = c(NH4+)。 28. (8分) (1)最初阶段电解反应的离子方程式为 Cu+2Br- Cu+Br2 (2分) 。 Cu+Br2 (2分) 。 (2) 2Br??2e?=Br2; 2Cl??2e?=Cl2; 4OH??4e?=2H2O+O2↑(依次每个1分) (2H2O?4e?=4H++O2↑也给分,但三个反应式的顺序不能交换) 。 (3) 蓝色逐渐消失,最后溶液变成橙色(或橙红色) (2分) 。 (4)最终溶液显 酸 性。(1分) 29.(14分) (1)A的化学式是H2SO3(2分);离子方程式:H2SO3+Cl2+H2O=4H++SO32-+2Cl-(3分)。 (2)Y的化学式是 SO3 (2分)。 (3)B在水中的电离方程式为 H3PO4 H++H2PO4-、 H2PO4- H++H2PO4-、 H2PO4- H++HPO42- H++HPO42- HPO42- H++PO43- (各1分) 。 H++PO43- (各1分) 。 (4)单质C是 P (1分) ,其形成的晶体属于 分子晶体(1分) (填晶体类型),其与Y反应的化学方程式为 5SO3+2P=5SO2+P2O5 (2分) 。 三.计算题(本大题只有1题,共7分) 30.(7分)电子工业常用一定浓度的FeCl3溶液腐蚀敷有铜箔的绝缘板,制成印刷线路板。有关反应为:2FeCl3+Cu=2FeCl2+CuCl2。 现将一块敷有铜箔的绝缘板浸入8.00×102
mL某FeCl3溶液A中,一段时间后,将该线路板取出,向所得溶液B中加入铁粉m g,充分反应后剩余固体n g;将固体滤出并从滤液C(忽略反应前后溶液体积变化)中取出20.00mL,向其中滴入3.00mol • L-1AgNO3溶液60.00 mL时,溶液中的Cl-恰好完全沉淀。请计算: (1)溶液A中FeCl3的物质的量浓度为 3.00mol • L-1 (1分)
; (2)假若铁粉不再溶解,向溶液B中加入的铁粉质量至少应当大于 67.2g
(1分) ; (3)讨论当剩余固体的组成不同时m与n可能的取值范围,并填入下表 剩余固体的组成 m的取值范围 n的取值范围 只有铜 0<m≤67.2(1分) 只写m≤67.2就给分 0<n≤76.8(1分) 只写n≤76.8就给分 有铁且有铜 m>67.2(1分) m-67.2<n≤m+9.6(1分) (4)当m=100.0,n=96.8时,溶液B中FeCl2的物质的量浓度为 2.5 mol • L-1。(1分)
| | | | | | | | | | | | | | | | | | |


 A.NaCl的电子式:
A.NaCl的电子式:  B.H2O分子的分子结构模型示意图:
(三个原子在同一直线上)
B.H2O分子的分子结构模型示意图:
(三个原子在同一直线上) Z
Z 3HNCO; 8HNCO+6NO2
3HNCO; 8HNCO+6NO2 7N2+8CO2+4H2O
7N2+8CO2+4H2O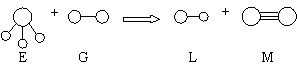
 ①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) H++OH-。欲使水的电离平衡向正方向移动,并使c(H+)增大,应加入的物质是
H++OH-。欲使水的电离平衡向正方向移动,并使c(H+)增大,应加入的物质是 xC(g) 有图I所示的反应曲线(T表示温度,P表示压强,C%表示C的体积分数)。试判断对图II的说法中正确的是
xC(g) 有图I所示的反应曲线(T表示温度,P表示压强,C%表示C的体积分数)。试判断对图II的说法中正确的是