1,3,5 A.将二氧化硫通入品红溶液中,溶液显红色,加热后又变为无色 B.向紫色石蕊试液中加入过氧化钠粉先变红后褪色。 C.将干燥的红布条放进盛有氯气的集气瓶中,红布条褪色 D.用标准氢氧化钠溶液滴定含甲基橙指示剂的盐酸,终点时溶液由红色变为无色
试题详情
10.
能正确表示下列反应的离子方程式是 A.向偏铝酸钠溶液中滴加过量的硫酸氢钠溶液:AlO2―+4H+ Al3++2H2O B.浓烧碱溶液中加入铝片:Al+2OH- = AlO2- +H2↑ 试题详情
C.以石墨作电极电解氯化镁溶液:2Cl-+2H2O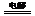 2OH-+H2↑+Cl2↑ 2OH-+H2↑+Cl2↑ D.硫酸亚铁溶液与稀硫酸、双氧水混合:Fe2++H2O2+2H+ = Fe3++2H2O 试题详情
二、选择题(本题包括10小题,每题3分,共30分。每小题只有一个选项符合题意) 11.以下数值等于阿伏加德罗常数的是 A.3g的金刚石晶体中所含的共价键数 试题详情
B.一定条件下,将0.5mol N2和1.5 mol H2充入一密闭容器内,充分反应后的生成物分子数 C.16gO2和O3混合物中所含的原子总数 D.64g铜片与含1mol H2SO4的浓硫酸共热,充分反应所转移的电子数 试题详情
12.下列关于置换反应:X+Y=W+Z(反应条件已经略去)的描述正确的是 A.若X是金属单质,则W和Z中一定有一种物质是金属单质 B.若X是非金属单质,则W和Z中一定有一种物质是非金属单质 C.若X是含有金属元素的化合物,则W和Z中一定有一种是含金属元素的化合物 D.若X是不含有金属元素的化合物,则W和Z中一定有一种物质是非金属单质 试题详情
13.短周期元素A、B、C的原子序数依次递增,它们的原子最外层电子数之和为10,A与C同主族,B原子的最外层电子数等于A原子的次外层电子数,则下列叙述正确的是 A.原子半径:A<B<C B.A的氢化物稳定性小于C的氢化物稳定性 C.三种元素的最高价氧化物对应水化物均可由化合反应得到 D.在一定条件下,A单质能置换出C单质,B能置换出A的单质。 试题详情
14.锑(Sb)在自然界一般以硫化物的形式存在,我国锑的蕴藏量占世界第一。从硫化物中提取单质锑一般是先在高温下将硫化物转化为氧化物,再用碳还原: 2Sb2S3+3O2+6Fe=Sb4O6+6FeS
……………………① Sb4O6+6C=4Sb+6CO ………………………………② 关于反应①、反应②的说法正确的是 A. 反应①②中的氧化剂分别是Sb2S3、Sb4O6
B.反应①中每生成3
mol FeS时,共转移6
mol电子 C.反应②说明高温下Sb的还原性比C强 D.每生成4 mol Sb时,反应①与反应②中还原剂的物质的量之比为4┱3 试题详情
15.在常温下的下列各组数据中,其比值为2:1的是
( ) A.pH=7的氨水与(NH4)2SO4的混合液中,c(NH4+)与c(SO42-
)之比. B.相同温度下,O.2mol/L 醋酸钠溶液与O.1mol/L醋酸钠溶液中c(CH3COO-)之比. C.H2CO3溶液中c(H+)与c(CO32- )之比. D.pH=2的H2SO4溶液与pH=1的盐酸溶液的物质的量浓度之比. 试题详情
试题详情
试题详情
A.N2(g)+3H2(g)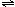 2NH3(g);△H=-Q1 kJ/mol(Q1>0) 2NH3(g);△H=-Q1 kJ/mol(Q1>0) 试题详情
B.2SO3(g)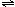 2SO2(g)+O2(g);△H=+Q2 kJ/mol(Q2>0) 2SO2(g)+O2(g);△H=+Q2 kJ/mol(Q2>0) 试题详情
C.4NH3(g)+5O2(g)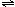 4NO+6H2O(g);△H=-Q3 kJ/mol(Q3>0) 4NO+6H2O(g);△H=-Q3 kJ/mol(Q3>0) 试题详情
D.H2(g)+
CO(g)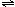 C(s)+H2O(g);△H=+Q4 kJ/mol(Q4>0) C(s)+H2O(g);△H=+Q4 kJ/mol(Q4>0) 试题详情
17.
将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为 ( ) 试题详情
试题详情
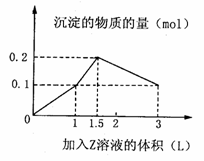
18.镁及其化合物一般无毒(或低毒)、无污染,且镁原电池放电时电压高而平稳,使镁原电池越来越成为人们研制绿色原电池的关注焦点。其中一种镁蓄电池的反应为: 试题详情
xMg
+ Mo3S4 MgxMo3S4在镁蓄电池放电和充电时,下列说法错误的是 ( ) A.放电时Mg发生氧化反应 B.放电时正极反应为:Mo3S4
+ 2xe-= Mo3S42x- C.充电时Mg2+向阳极迁移 D.充电时阴极反应为:xMg2++2xe-=xMg 试题详情
 19.某1 L混合溶液中,溶质X、Y的浓度都为0.1 mol?L-1,向混合溶液中滴加某溶液Z(0.1 molL-1氢氧化钠或硫酸溶液),所得沉淀的物质的量如图所示,则X、Y、Z分别是 19.某1 L混合溶液中,溶质X、Y的浓度都为0.1 mol?L-1,向混合溶液中滴加某溶液Z(0.1 molL-1氢氧化钠或硫酸溶液),所得沉淀的物质的量如图所示,则X、Y、Z分别是
A.硫酸铝、硫酸铁、氢氧化钠
B.硫酸铝、硫酸镁、氢氧化钠
C.偏铝酸钠、氢氧化钡、硫酸
D.偏铝酸钠、氯化钡、硫酸 试题详情
20.将6.3克镁铝合金粉末投入到500mL某稀硝酸中,经充分反应后,测得合金和HNO3均无剩余。已知反应放出的气体在标准状况下为4.48L。假定反应前后溶液的体积不变且还原产物只有NO一种,则原硝酸的物质的量浓度是 ( ) 试题详情
A.0.8mol/L B.1.6mol/L C.1.4mol/L D.0.75mol/L 玉田一中2008--2009第一学期高三期中统一考试 化 学 试 卷 第II卷(非选择题 共60分) 试题详情
21、(6分)含氮废水进入水体而对环境造成的污染越来越严重,某课外兴趣小组用金属铝将 NO3-还原为N2,从而消除污染。 (1)配平下列有关反应的离子方程式: NO3-+ Al+ H2O→ N2↑+ Al(OH)3↓+ OH- (2)上述反应中,还原剂是________,每生成2molN2,将有_______mol电子发生转移。 试题详情
22.(6分)有一类无机化合反应的通式可以表示为:单质+化合物(1)=化合物(2),请写出满足以下要求的任意三个此类无机化合反应的化学方程式:
①所涉及的元素的原子序数都小于30 ②三个方程式的3种单质不能相同。 (1)
; (2)
; (3)
; 试题详情
23.(6分)短周期元素A、B、C、D的原子序数依次增大。 ①C的最外层电子数比最内层电子数少一个; ②A、B形成的化合物X与B的最高价氧化物对应的水化物Y,发生化合反应生成Z; ③电解C、D 形成的化合物的水溶液,两极均放出气体且相同条件下气体体积相等。 试回答: (1)B为
,D为
(填元素符号),X的电子式为
。 (2)Z的水溶液呈现
(填“酸性”、“碱性”或“中性”),只用离子方程式说明原因
。 (3)当电解C、D形成的化合物(足量)的水溶液500mL时,两极共产生气体1120mL(标 况),则溶液的pH= (假设溶液体积不变,温度为常温) 试题详情
24.(l2分) 物质A有如下图所示转化关系,其中乙为金属单质,常温下,它在G 的浓溶液中发生钝化, F 的溶液中只含有一种溶质(有的反应可能在水溶液中进行,有的反应的生成物未全部给出,反应条件也未注明)。请讨论以下两种情况(注:两种情况下各字母代表的物质可能不同) 试题详情
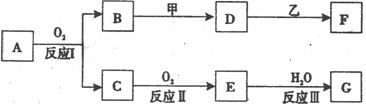
(l)第一种情况:用两根玻璃棒分别蘸取 A、G的浓溶液并使它们接近时,有大量白烟生成;甲为焰色反应呈黄色的金属单质; D 和 F 的溶液均呈碱性。则: ① B与甲反应的化学方程式为____________________ ___________________。 ② G的化学式为 ③ D与乙反应的离子方程式为__________________________ _________。 (2)第二种情况:
甲由两种气态单质直接化合得到;B 为红棕色固体; C为能使品红试液褪色的有刺激性气味的无色气体;D 的水溶液加入用硝酸酸化的AgNO3溶液有白色沉淀生成。则: ① 工业上,反应 I 在___________________(填设备名称)中进行。 ② G的化学式为______________。 ③ D和C反应的离子方程式为______________________
___。 试题详情
25、(10分)某待测溶液(阳离子为Na+或K+)中只可能含有OH―、SO42-、SO32-、Cl-、Br-、HCO3-中的一种或若干种,进行下列实验(每次实验所加试剂均过量): 试题详情
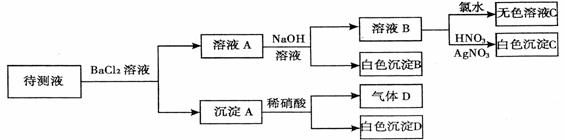
回答下列问题: (1)待测液中肯定存在的阴离子是 ; 肯定不存在的阴离子是 ; 可能存在的阴离子是 。 (2)反应生成沉淀B的离子方程式为
(4)检验溶液中是否含SO42-的方法是
试题详情
26、(14分)氨气与灼热的氧化铜反应生成铜、氮气和水。利用下图所示实验装置可测定氨分子的组成(图中夹持、固定装置部分均略去)。回答下列问题: 试题详情
⑴写出氨气与氧化铜反应的化学方程式:
。 (2)在干燥管B中不能选用的干燥剂是
(填序号); A.碱石灰 B.生石灰
C.五氧化二磷 D.浓硫酸 (3)在C的玻璃管中观察到的现象是:
。 (4)E装置中盛装浓硫酸的目的是:
; (5)待实验完毕后,若实验测得N2的体积(折算成标准状况)a L,则被还原的氧化铜的物质的量为: mol;若测得干燥管D增重b g, 则氨分子中氮、氢的原子个数比为(用含a、b字母的代数式表 示) 。 (6)上述实验中,如果省去B装置,测定氨分子组成的N、H原子个数的比值将会(填“增大”、 “减少”或“无影响”) ,理由是:
。 试题详情
27、(6分)将2.5g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol?L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示: 试题详情
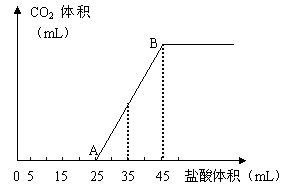 (1)写出OA段所发生反应的离子方程式 (1)写出OA段所发生反应的离子方程式
______________________________________
(2)当加入35mL盐酸时,产生CO2的体积为___________mL(标准状况)。 (3)原混合物中NaOH的质量及碳酸钠的质量分数为
。 玉田一中2008--2009第一学期12月份高三阶段考试(答案) 试题详情
一、选择题 1、B 2、A 3、C 4、D 5、B 6、D 7、C 8、B 9、B 10、A 试题详情
二、选择题 11、C 12、D 13、D14、B 15、A16、B 17、C 18、C 19、C 20、B 试题详情
三、填空简答题 21、(6分) (1)6、10、18、3、10、6;(2分) (2)Al (2分) 20(2分) 试题详情
试题详情
试题详情
(4) 2FeCl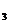 + Fe = 2FeCl + Fe = 2FeCl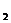 试题详情

(1)N Cl
(每空1分) (2) 酸性
试题详情
 NH4+
+ H2O NH3?H2O+H+ NH4+
+ H2O NH3?H2O+H+
(3)13 试题详情
24.(12分)每空2分 (1)①2Na +2H2O = 2NaOH + H2↑
(2分) ②HNO3
(2分) ③2Al+2OH-+2H2O = 2AlO2-+3H2↑
(2分) (2)①沸腾炉
(2分) ②H2SO4 (2分) ③2H2O+SO2+2Fe3+
=2Fe2+
+SO42-+4H+ (2分) 试题详情
25、每空2分 (1) SO32- 、HCO3-;(2分)Br-、OH―;(2分)SO42-、Cl-(2分) (2)Ba2++HCO3―+OH―=BaCO3↓+H2O (2分) (3)取原待测液先加入过量的盐酸,再加入过量的BaCl2溶液,若有白色沉淀产生,则说明溶液中有SO42-;若没有白色沉淀产生,则说明溶液中没有SO42-;(2分) 试题详情
试题详情
⑴2NH3 + 3CuO  3Cu + N2 + 3H2O 。。 3Cu + N2 + 3H2O 。。 (2) C、D (填序号); (3)黑色固体变成了亮红色 。 (4)吸收多余的NH3 ; 试题详情
(5)3a/22.4mol;9a/11.2b 。 (6)减少 ,因为由NH3带出的水蒸气进入D装置 试题详情
27、 (1)H+ + OH― = H2O,CO32― + H+ = HCO3― (2分) (2)224mL(2分) (3)(2分) 设碳酸钠、碳酸氢钠和氢氧化钠的物质的量分别为x、y、z,则 试题详情
 x +
y = 1mol/L×(0.045-0.025)L x +
y = 1mol/L×(0.045-0.025)L
试题详情
z - y =
1mol/L×[0.025-(0.045-0.025)]L 试题详情
84g/mol?x + 106g/mol?y + 40g/mol?z = 2.5g 试题详情
x=0.01mol,y=0.01mol,z=0.015mol 试题详情
所以,NaOH的质量为0.6g,Na2CO3的质量分数为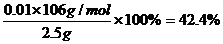 试题详情
| | | 