
高一化学同步测试二氧化硫
YCY
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分.共100分,考试用时60分钟.
第Ⅰ卷(选择题,共50分)
以下数据可供解题时参考:
相对原子质量 H1 O16 S32 Na23
一、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意)
1.下列物质能与SO2气体起反应,但无沉淀产生的是 ( )
①溴水 ②氢氧化钡溶液 ③石灰水 ④碳酸钠 ⑤稀硫酸 ⑥硫酸钠 ⑦亚硫酸钠
A.① B.①④⑤ C.④⑥⑦ D.①④⑦
2.银耳本身为淡黄色,福建省一些县出产一种雪耳,颜色洁白如雪。其制造过程如下:将银耳堆
放在密封良好的塑料棚内,在棚的一端支一口锅,锅内放硫磺,加热硫磺熔化并燃烧,两天左
右,雪耳就制成了,雪耳炖不烂,且对人有害。制作雪耳利用的是 ( )
A.硫的还原性 B.硫的漂白性
C.二氧化硫的还原性 D.二氧化硫的漂白性
3.为除去CO2气体中混有少量杂质SO2气体,应选用的试剂是 ( )
A.Na2CO3溶液 B.饱和NaHCO3溶液
C.NaOH溶液 D.NaHSO3溶液液
4.将等物质的量的干燥的二氧化硫和氯气的混合气体通过潮湿的有色布条,对其漂白效果
的说法较合理的是 ( )
A.漂白效果增加 B.漂白效果降低
C.漂白的效果是二者之和 D.完全失去漂白效果
5.下列物质均有漂白性,漂白原理相同的是 ( )
① 木碳 ② 氯水 ③ 漂白粉 ④ 过氧化钠 ⑤ 双氧水 ⑥ 二氧化硫
A.①⑥ B.③④⑥ C.④⑤⑥ D.②④⑤
6.某气体水溶液呈酸性,该气体能使酸性高锰钾溶液褪色,也能使品红褪色,该气体是( )
A.HBr B.CO
7.下列物质的溶液露置于空气中,开始一段时间其pH变小的是( )(不考虑溶质及溶
剂的挥发)
①H2SO4 ②H2SO3 ③H2S ④NaOH ⑤氯水
A.①②④ B.②⑤ C.①②④⑤ D.②④⑤
8.你认为减少酸雨产生的途径可采取的措施是 ( )
①少用煤作燃料②把工厂烟囱造高③燃料脱硫④在已酸化的土壤中加石灰⑤开发新能源
A.①②③ B.②③④⑤ C.①③⑤ D.①③④⑤
9.X、Y两元素可形成电子层结构相同的阴离子,X的氢化物水溶液呈弱酸性,向其中通入
X元素的氧化物或Y的单质,则有X的单质析出,由此可知X、Y可能是 ( )
A.O和F B.S和Cl C.F和S D. S和Br
10.一定物质的量的SO2与NaOH溶液反应,所得溶液中含Na2SO3和NaHSO3,若两者物质的量之比为3:5,则参加反应的SO2与NaOH的物质的量之比为 .... ( )
A.3:5 B.1:
二、选择题(本题包括5小题,每小题4分,共20分。在每题给出的四个选项中,有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确给满分,但只要选错一个该小题就为0分)
11.某雨水样品刚采集时测得pH值为4.82,放在烧杯中经2小时后,再次测得pH值为4.68。以下叙述正确的是 ( )
A.雨水样品酸度逐渐减小
B.雨水样品酸度没有变化
C.雨水样品继续吸收空气中的CO2
D.雨水样品中的H2SO3逐渐被空气中的氧气氧化成H2SO4
12.将SO2通入BaCl2溶液中至饱和,未产生沉淀,继续通入或加入适量某一物质(x)仍无沉淀,则x是 ( )
A.H2S B.NaOH C.CO2 D.Cl2
13.对硫酸亚铁加热发生如下反应:2FeSO4====Fe2SO3+SO2↑+SO3↑,如果把产生的气体通入BaCl2溶液中,其结果是 ( )
A.有BaSO4沉淀,SO2从溶液中逸出
B.有BaSO4沉淀,SO3从溶液中逸出
C.SO2和SO3全部吸收,并有BaSO4沉淀产生
D.产生BaSO4和BaSO3的混合沉淀
14.在元素周期表短周期中的X和Y两种元素可组成化合物XY3,下列说法正确的是( )
A.XY3一定是离子化合物
B.若Y的原子序数为n,X的原子序数一定是n土4
C.X和Y可属于同一周期,也可属于两个不同周期
D.X和Y一定不属于同一主族
15.已知:Na2S2O3 + H2SO4=Na2SO4 + S↓ + SO2↑ + H2O ,SO2+2H2S==3S↓+2H2O
将含amol Na2S的溶液和含bmol Na2S2O3的溶液混合,然后加入硫酸酸化。酸化后的溶液无任何气体逸出,由此推知a/b为 ( )
A.1:2 B.2:
第Ⅱ卷(非选择题 共50分)
三、填空、简答和计算(共8个小题,满分50分)
16.(4分)下列溶液中通入SO2时都会褪色,但二氧化硫的作用却可能不同。请分别再横线上写出在各变化中所体现的二氧化硫的性质:
SO2通入酸性高锰酸钾溶液中红色褪去。______
SO2通入品红溶液红色褪去。________
SO2通入溴水溶液中红棕色褪去。_______
SO2通入氢氧化钠与酚酞的混合溶液红色褪去。_______
17.(5分)在BaBr2溶液中滴入氯水,观察到的现象是______________,再通入SO2,观察到的现象是__ ____________,反应的离子方程式是:①______________;
②______________;③______________。
18.(8分)(1)为降低硫的氧化物对空气的污染,可把氧化钙和含硫的煤混和后燃烧,这种方法叫做钙基固硫,试写出有关的化学方程式 _________________、________________.
(2)火力发电站废气中含有SO2。为除去有害气体SO2,可用碳酸钙或氢氧化钙的悬浊洗涤,反应产物为CaSO4,写出上述两种途径有关的化学方程式。
①
②
试说明用熟石灰的悬浊液,而不用澄清石灰水洗涤废气的理由_________________
______________________________________________________________________
19.(6分)有一瓶无色气体可能有含有H2、CO2、HBr、SO2、Cl2中的一种或几种。将其通入稀氯水中得到的无色透明溶液。将溶液分成两份,向其中一份加入用稀HNO3酸化的AgNO3溶液,生成白色沉淀;向另一份中加入用稀盐酸化的BaCl2溶液,也生成白色沉淀。
(1)原气体中肯定含有______________,可能含有______________。
(2)对可能含有的成分,请你设计一套简单合理的实验方案,检验其有无,并具体说明在此方案中气体通过各试剂的作用。(用文字表示所用试剂先后顺序,用→表示气体流向)_______________________________________________________________
20.(7分)为了验证浓H2SO4和木炭在加热时发生反应生成水、二氧化碳和二氧化硫。为确认各种产物,甲、乙两学生分别设计如下实验方案:(图中→表示气体流向)
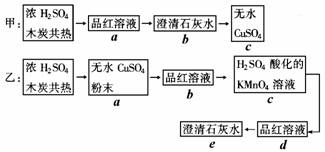
(1)上述甲、乙两方案中可达到实验目的的是______________(填“甲”或“乙”)。
(2)简述方案不可行的理由__________________________________________________
(3)具体说明能达到实验目的的方案中,气体通过的各装置(用字母表示)的作用:_____________________________________________________________________
21.(10分)已知硫化氢和二氧化硫能够发生如下反应:2H2S+SO2=3S+2H2O。
298K时,向VL真空容器内通入m mol的H2S和n molSO2将它们混合在某一密闭容器中反应:
(1)上述反应中,氧化产物与还原产物的物质的量之比为_________。
(2)若n=2,则当m=______时,反应后容器内密度最小。
(3)若2n>m,则反应后氧化产物与还原产物的质量差为_____g
(4)若5n=m,且反应后氧化产物和还原产物的质量和为
 (5)如反应后气体体积是反应前的1/4,则m和n之比是______.
(5)如反应后气体体积是反应前的1/4,则m和n之比是______.
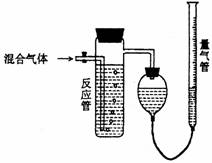
22.(10分)工业上测量SO2、N2、O2混合
气体中SO2含量的装置如下图;反应管中
装有碘的淀粉溶液。SO2和I2发生的反应为
(N2、O2不与I2反应):SO2+I2+2H2O→H2SO4+2HI
(1)混合气体进入反应管后,量气管内增加
的水的体积等于 的体积(填写气体的分子式)。
(2)反应管内溶液蓝色消失后,没有及时停止通气,
则测得的SO2含量 (选填:偏高,偏低,不受影响)。
(3)反应管内的碘的淀粉溶液也可以用 代替(填写物质名称)。
(4)若碘溶液体积为VamL.,浓度为Cmol?L-1,N2与O2的体积为VbmL(已折算为标准状况下的体积)。用C、Va、Vb表示SO2的体积百分含量为: 。
(5)将上述装置改为简易实验装置,除导管外,还需选用的仪器为. (选下列仪器的编号)。
a.烧杯 b.试管 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞
一、选择题
题号
1
2
3
4
5
6
7
8
9
10
答案
D
D
B
D
D
C
D
C
B
D
二、选择题
题号
11
12
13
14
15
答案
AD
C
A
C
B
三、填空、简答和计算
16.(1)还原性;(2)漂白性;(3)还原性;(4)酸酐的性质。
17.溶液变为棕色 溶液变为无色并有白色沉淀 ①Cl2+2Br-=2Cl-+Br2
②Br2+SO2+2H2O=SO42-+2Br-+4H+ ③Ba2++SO42-=BaSO4↓
18.(1)S+O2 = SO2 ,2CaO+2SO2+O2 == 2CaSO4(或:SO2+CaO=CaSO3;2CaSO3+O2=2CaSO4)
(2)①2SO2+2CaCO3+O2+4H2O==2CaSO4?2H2O+2CO2
②2SO2+2Ca(OH)2+O2+2H2O==2CaSO4?2H2O
因为石灰乳中Ca(OH)2的含量较多,吸收SO2的容量较大
19.(1)SO2;CO2 (2)过量酸性KMnO4溶液→品红试液→澄清石灰水。
20.(1)乙 (2)甲方案不可行的理由是:用品红溶液检验生成的二氧化硫时,吸收二氧化硫可能不充分,影响二氧化碳气体的检验;同时气体通过品红溶液和澄清石灰水时,也会打出水汽,影响对生成物中水的检验。
(3)A.验证反应生成的水 B.验证产生的SO
21.(1)2∶1(2)4 (3)
22.(1)N2、O2的体积;(2)偏低;(3)酸性高锰酸钾溶液或溴水
(4)VSO2%=22.4CVa/(22.4CVa+Vb)×100%(其它合理答案也给分)
(5)b、c、e、g或b、e、g或c、e、g。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com