
科目:gzhx 来源: 题型:
B.1 mol MnO2粉末与400 mL 10 mol·L-1的盐酸共热
C.常温下1 mol铝片投入到200 mL 18.4 mol·L-1硫酸中
D.常温下1 mol铜片投入含4 mol HNO3的浓硝酸中
科目:gzhx 来源: 题型:
下列实验中金属或氧化物可以完全溶解的是 ( )
A.0.1 mol锌片投入到100 mL 1 mol・L-1的盐酸溶液中
B.1 mol MnO2粉末与400 mL10 mol・L-1的盐酸共热
C.常温下1mol铝片投入到200mL18.4mol・L-1硫酸中
D.常温下 1 mol铜片投入含4molHNO3的浓硝酸中
科目:gzhx 来源:2011-2012学年广东省龙川一中高一5月月考化学试卷(带解析) 题型:实验题
(10分)某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:
实验①:把纯锌片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:
实验②:把纯锌片投入到含FeCl3的同浓度工业稀盐酸中,发现放出氢气的量减少。
实验③:在盐酸中滴入几滴CuCl2溶液,生成氢气速率加快。
试回答下列问题:
(1)试分析实验①中t1~t2速率变化的主要原是 ,t2~t3速率变化的主要原因是 。
(2)实验②放出氢气的量减少的原因是(用离子方程式表示) 。
(3)某同学认为实验③反应速率加快的主要原因是因为形成了原电池,你认为是否正确?
(填“正确”或“不正确”)。
请选择下列相应的a或b作答。
a、若不正确,请说明原因:
b、若正确则写出实验③中原电池的正极电极反应式:_________________________
科目:gzhx 来源:2011-2012年江苏省无锡市第一中学高一下学期期中考试化学试卷 (带解析) 题型:实验题
(6分)某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:
实验①:把纯锌片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:
实验②:把纯锌片投入到含FeCl3的同浓度工业稀盐酸中,发现放出氢气的量减少。
实验③:在盐酸中滴入几滴CuCl2溶液,生成氢气速率加快。
试回答下列问题:
(1)试分析实验①中t1~t2速率变化的主要原因是 ,
t2~t3速率变化的主要原因是 。
(2)实验②放出氢气的量减少的原因是 。
(3)某同学认为实验③反应速率加快的主要原因是因为形成了原电池,你认为是否正确?
(填“正确”或“不正确”)。
请选择下列相应的a或b作答。
a.若不正确,请说明原因:
b.若正确则写出实验③中原电池的正、负极电极反应式。
科目:gzhx 来源: 题型:
(6分)某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:
实验①:把纯锌片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:
实验②:把纯锌片投入到含FeCl3的同浓度工业稀盐酸中,发现放出氢气的量减少。
实验③:在盐酸中滴入几滴CuCl2溶液,生成氢气速率加快。
试回答下列问题:
(1)试分析实验①中t1~t2速率变化的主要原因是 ,
t2~t3速率变化的主要原因是 。
(2)实验②放出氢气的量减少的原因是 。
(3)某同学认为实验③反应速率加快的主要原因是因为形成了原电池,你认为是否正确?
(填“正确”或“不正确”)。
请选择下列相应的a或b作答。
a.若不正确,请说明原因:
b.若正确则写出实验③中原电池的正、负极电极反应式。
科目:gzhx 来源:2011-2012年江苏省无锡市高一下学期期中考试化学试卷(解析版) 题型:实验题
(6分)某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:
实验①:把纯锌片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:

实验②:把纯锌片投入到含FeCl3的同浓度工业稀盐酸中,发现放出氢气的量减少。
实验③:在盐酸中滴入几滴CuCl2溶液,生成氢气速率加快。
试回答下列问题:
(1)试分析实验①中t1~t2速率变化的主要原因是 ,
t2~t3速率变化的主要原因是 。
(2)实验②放出氢气的量减少的原因是 。
(3)某同学认为实验③反应速率加快的主要原因是因为形成了原电池,你认为是否正确?
(填“正确”或“不正确”)。
请选择下列相应的a或b作答。
a.若不正确,请说明原因:
b.若正确则写出实验③中原电池的正、负极电极反应式。
科目:gzhx 来源:2014届广东省高一5月月考化学试卷(解析版) 题型:实验题
(10分)某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:
实验①:把纯锌片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:
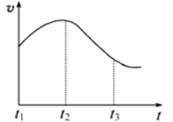
实验②:把纯锌片投入到含FeCl3的同浓度工业稀盐酸中,发现放出氢气的量减少。
实验③:在盐酸中滴入几滴CuCl2溶液,生成氢气速率加快。
试回答下列问题:
(1)试分析实验①中t1~t2速率变化的主要原是 ,t2~t3速率变化的主要原因是 。
(2)实验②放出氢气的量减少的原因是(用离子方程式表示) 。
(3)某同学认为实验③反应速率加快的主要原因是因为形成了原电池,你认为是否正确?
(填“正确”或“不正确”)。
请选择下列相应的a或b作答。
a、若不正确,请说明原因:
b、若正确则写出实验③中原电池的正极电极反应式:_________________________
科目:gzhx 来源: 题型:阅读理解
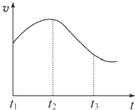 (思维拓展题)某研究学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:
(思维拓展题)某研究学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:| 负极材料 | 正极材料 | 负极反应式 | 正极反应式 | 电解质溶液 | |
| 实验三 | Zn | 杂质 | Zn-2e-=Zn2+ | 2H++2e-=H2↑ | 盐酸 |
| 实验四 | Zn | Cu | Zn-2e-=Zn2+ | 2H++2e-=H2↑ | 盐酸 |
| 负极材料 | 正极材料 | 负极反应式 | 正极反应式 | 电解质溶液 | |
| 实验三 | Zn | 杂质 | Zn-2e-=Zn2+ | 2H++2e-=H2↑ | 盐酸 |
| 实验四 | Zn | Cu | Zn-2e-=Zn2+ | 2H++2e-=H2↑ | 盐酸 |
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:
C.1.2 mol·L-1·min-1 D.1.8 mol·L-1·min-1
科目:gzhx 来源:2013届浙江省高二上学期期中考试化学(文)试卷 题型:选择题
下列离子方程式中正确的是
A、将盐酸滴入氢氧化铜悬浊液中 H++OH一= H2O
B、将小苏打溶液加入醋酸中 HCO3-+H+=C02↑+ H2O
C、将锌片投入到CuSO4溶液中 Zn+Cu2+=Zn2++Cu
D、将Fe粉投入稀硫酸中 2Fe+6H+=2Fe3++3H2↑
科目:gzhx 来源:2010-2011学年福建省高三12月月考化学试卷 题型:选择题
下列说法正确的是
A. 0.1 mol·L-1的盐酸和0.1 mol·L-1的醋酸分别与2 mol·L-1的NaOH反应的速率相同
B.用锌和稀硫酸反应制取氢气时,加入少量硫酸铜溶液会使生成氢气的反应加快
C. Mg粉和Fe粉分别与0.1 mol·L-1的盐酸反应速率相同
D. 大理石块与大理石粉分别与0.1 mol·L-1的盐酸反应的速率相同
科目:gzhx 来源: 题型:
(10分)某研究学习小组为探究锌与盐酸反应,取同质量、同体积的锌片,同浓度盐酸做了下列平行实验:
实验一、把纯锌片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:
实验二、把纯锌片投入到含FeCl3的同浓度工业盐酸中,发现放出氢气量减少。
实验三、将不纯的锌片与盐酸反应,发现反应速率加快。
实验四、在盐酸中滴入几滴CuCl2溶液,同样生成氢气速率加快。
问题:
(1)试分析实验一中t1~t2速率变化的主要原因是 ,t2~t3速率变化的主要原因是 。
(2)实验二放出氢气量减少的原因是 。
(3)某同学认为实验四反应速率加快原因,均为原电池的存在,你认为是否正确,若不正确,说明原因。若正确写出原电池的正、负极及电解质溶液。
科目:gzhx 来源:2012年苏教版高中化学选修6 6.2镀锌铁皮锌镀层厚度的测定练习卷(解析版) 题型:选择题
把锌片投入到下列溶液中,锌片溶解且溶液质量减轻,又没有气体产生的是( )
A.H2SO4 B.CuSO4
C.ZnSO4 D.AgNO3
科目:gzhx 来源:2010年陕西省西安铁一中高一第二学期期中考试化学试题 题型:填空题
(10分)某研究学习小组为探究锌与盐酸反应,取同质量、同体积的锌片,同浓度盐酸做了下列平行实验:
实验一、把纯锌片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:
实验二、把纯锌片投入到含FeCl3的同浓度工业盐酸中,发现放出氢气量减少。
实验三、将不纯的锌片与盐酸反应,发现反应速率加快。
实验四、在盐酸中滴入几滴CuCl2溶液,同样生成氢气速率加快。
问题:
(1)试分析实验一中t1~t2速率变化的主要原因是 ,t2~t3速率变化的主要原因是 。
(2)实验二放出氢气量减少的原因是 。
(3)某同学认为实验四反应速率加快原因,均为原电池的存在,你认为是否正确,若不正确,说明原因。若正确写出原电池的正、负极及电解质溶液。
科目:gzhx 来源: 题型:
在室温下,将表面积相同、纯度相同、体积也相同的同种锌片分别投入100mL0.1mol/L的稀硫酸和0.2mol/L的稀盐酸中,仔细观察后发现,两者反应速率有明显差异,投入到稀硫酸中的锌片表面产生的气泡没有投入到稀盐酸的快。大家分析、讨论后认为产生这一现象的原因可能有两个:氯离子对反应起了正的催化作用,及加快了反应的进行。另一种可能是硫酸根离子对反应起了负催化作用,及阻碍了反应的进行。持前一种观念的三位同学设计实验并根据实验现象均认为证实了自己的推论是正确的,他们的实验方案和实验现象分别是:
甲:在室温下,将表面积相同、纯度相同、体积也相同的同种锌片投入到100mL0.1mol/L的稀硫酸中,并加入适量氯化钠固体,发现反应速率加快。
乙:在室温下,将表面积相同、纯度相同、体积也相同的同种锌片投入到100mL0.1mol/L的稀硫酸中,并加入适量氯化锌固体,发现反应速率加快。
丙:在室温下,将表面积相同、纯度相同、体积也相同的同种锌片投入到100mL0.1mol/L的稀硫酸中,并加入适量氯化钡固体,发现反应速率加快。
请你对三位同学的实验方案作出评价,他们能否得出“氯离子对反应起了正的催化作用”的结论,并简要说出理由:
甲:________,___________________________________________________________________。
乙:________,___________________________________________________________________。
丙:________,___________________________________________________________________。
科目:gzhx 来源: 题型:
下列说法正确的是
A. 0.1 mol·L-1的盐酸和0.1 mol·L-1的醋酸分别与2 mol·L-1的NaOH反应的速率相同
B.用锌和稀硫酸反应制取氢气时,加入少量硫酸铜溶液会使生成氢气的反应加快
C. Mg粉和Fe粉分别与0.1 mol·L-1的盐酸反应速率相同
D. 大理石块与大理石粉分别与0.1 mol·L-1的盐酸反应的速率相同
科目:gzhx 来源: 题型:
A.0.1 mol B.0.2 mol C.0.3 mol D.0.4 mol