
科目:gzhx 来源:福建三明一中2008-2009学年高二下学期第一次月考化学试题 题型:013
|
在相同温度下等体积、等物质的量浓度的4种稀溶液:①Na2SO4 ②H2SO3 ③NaHSO3 ④Na2S,所含带电微粒的数目由多到少的顺序是 | |
| [ ] | |
A. |
①=④>③=② |
B. |
①=④>③>② |
C. |
①>④>③>② |
D. |
④>①>③>② |
科目:gzhx 来源:福建省三明一中2010-2011学年高二上学期第二次月考化学试题 题型:013
|
在相同温度下等体积、等物质的量浓度的4种稀溶液: ①Na2SO4 ②H2SO3 ③NaHSO3 ④Na2S, 所含带电微粒的数目由多到少的顺序是 | |
| [ ] | |
A. |
①=④>③=② |
B. |
①=④>③>② |
C. |
①>④>③>② |
D. |
④>①>③>② |
科目:gzhx 来源: 题型:
在相同温度下等体积、等物质的量浓度的4种稀溶液:①Na2SO4 ②H2SO3 ③NaHSO3
④Na2S,所含带电微粒的数目由多到少的顺序是( )
A.①=④>③=② B.①=④>③>②
C.①>④>③>② D.④>①>③>②
科目:gzhx 来源: 题型:
在相同温度下等体积、等物质的量浓度的4种稀溶液:①Na2SO4 ②H2SO3 ③NaHSO3④Na2S,所含带电微粒的数目由多到少的顺序是
A.①=④>③=② B.①=④>③>②
C.①>④>③>② D.④>①>③>②
科目:gzhx 来源: 题型:
| 容器 | 甲 | 乙 | 丙 | 丁 |
| 起始加入量 | 2mol SO2+1mol O2 | 1mol SO2+0.5mol O2 | 2mol SO3 | 2mol SO2+2mol O2 |
| 反应放出或吸收的热量/kJ | a | b | c | d |
| 平衡时c(SO3)/mol•L-1 | e | f | g | h |
| A、a<2b:e>2f |
| B、a=c:e=g |
| C、a>d:e>h |
| D、c+98.3e=196.6 |
科目:gzhx 来源: 题型:
| 容器 | 甲 | 乙 | 丙 |
| 起始投入量 | 2mol SO2和1mol O2 | 2mol SO3 | 2mol SO2和2mol O2 |
| 反应放出或吸收的 热量(kJ) |
Q1 | Q2 | Q3 |
| 平衡时SO3的物质的量 | n1 | n2 | n3 |
| 平衡转化率 | α1 | α2 | α3 |
| 平衡时压强 | p1 | p2 | p3 |
| A、Q1=Q2>Q3 |
| B、n2>n1>n3 |
| C、α1+α2=1 |
| D、p1>p2>p3 |
科目:gzhx 来源: 题型:
 (2012•青浦区二模)硫-碘循环分解水制氢的主要反应如下:
(2012•青浦区二模)硫-碘循环分解水制氢的主要反应如下:科目:gzhx 来源:2011-2012学年江苏省南京市四校高三12月月考化学试卷 题型:选择题
在相同温度和体积均为1L的四个密闭容器中,保持温度和容积不变,以四种不同的投料进行反应。平衡时有关数据如下
(已知相同条件下:2SO2+O2 2SO3 △H =-196.6kJ/mol)。
2SO3 △H =-196.6kJ/mol)。
|
容器 |
甲 |
乙 |
丙 |
丁 |
|
起始投入量 |
2molSO2+1molO2 |
1molSO2+0.5molO2 |
2molSO3 |
2molSO2+2molO2 |
|
反应放出或 吸收的热量(kJ) |
a |
b |
c |
d |
|
平衡时c(SO3)(mol/L) |
e |
f |
g |
h |
下列关系正确的是
A. a=c;e=g B. a>2b;e>2f C. a>d;e>h D. c+98.3e=196.6
科目:gzhx 来源:2013-2014学年山东省青岛市城阳区高三上学期学分认定考试化学试卷(解析版) 题型:填空题
硫一碘循环分解水制氢的主要反应如下:
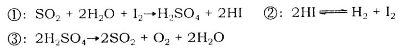
(1)上述循环反应的总反应可以表示为____________________;反应过程中起催化作用的物质是__________(选填编号)。
a.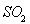 b.
b.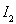 c.
c.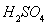 d.HI
d.HI
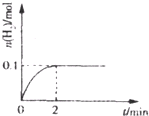
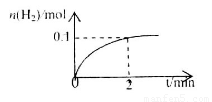
(2)一定温度下,向2L密闭容器中加入1molHI(g),发生反应II,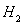 的物质的量随时间的变化如图所示。0~2min内的平均反应速率
的物质的量随时间的变化如图所示。0~2min内的平均反应速率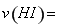 _________。
_________。
(3)对反应II,在相同温度和体积下,若开始加入的HI(g)的物质的量是原来的2倍,则以下_________也是原来的2倍(选填编号),
a.平衡常数 b.HI的平衡浓度
c.达到平衡时间 d.平衡时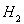 的体积分数
的体积分数
(4)实验室用锌和稀硫酸反应制取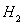 ,反应时溶液中水的电离平衡______移动(选填“向左”、“向右”或“不”);若加入少量下列试剂中的_____(选填编号),产生
,反应时溶液中水的电离平衡______移动(选填“向左”、“向右”或“不”);若加入少量下列试剂中的_____(选填编号),产生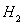 的速率将增大。
的速率将增大。
a. b.
b. c.
c.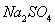 d.
d.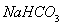
科目:gzhx 来源:新课程同步学案专家伴读 化学选修4(化学反应原理) 鲁科版 鲁科版 题型:022
一定条件下,在一定体积的密闭容器中,可逆反应A2(g)+B2(g)![]() 2C(g)达到平衡时,各物质的平衡浓度分别为c(A2)=0.5 mol·L-1;c(B2)=0.1 mol·L-1;c(C)=1.6 mol·L-1.若用a、b、c分别表示A2、B2、C的初始浓度(mol·L-1),已知a、b、c均不为0,在相同温度和体积下,各物质的浓度和原平衡相同.则:
2C(g)达到平衡时,各物质的平衡浓度分别为c(A2)=0.5 mol·L-1;c(B2)=0.1 mol·L-1;c(C)=1.6 mol·L-1.若用a、b、c分别表示A2、B2、C的初始浓度(mol·L-1),已知a、b、c均不为0,在相同温度和体积下,各物质的浓度和原平衡相同.则:
(1)a、b应满足的关系是________.
(2)a的取值范围是________.
科目:gzhx 来源:江苏省南京市四校2012届高三12月月考化学试题 题型:021
|
在相同温度和体积均为1 L的四个密闭容器中,保持温度和容积不变,以四种不同的投料进行反应.平衡时有关数据如下(已知相同条件下:2SO2+O2
下列关系正确的是 | |
A. |
a=c;e=g |
B. |
a>2b;e>2f |
C. |
a>d;e>h |
D. |
c+98.3e=196.6 |
科目:gzhx 来源:2012届江苏省南京市四校高三12月月考化学试卷 题型:单选题
在相同温度和体积均为1L的四个密闭容器中,保持温度和容积不变,以四种不同的投料进行反应。平衡时有关数据如下
(已知相同条件下:2SO2+O2 2SO3 △H =-196.6kJ/mol)。
2SO3 △H =-196.6kJ/mol)。
| 容器 | 甲 | 乙 | 丙 | 丁 |
| 起始投入量 | 2m olSO2+1molO2 olSO2+1molO2 | 1molSO2+0.5molO2 | 2molSO3 | 2molSO2+2molO2 |
| 反应放出或 吸收的热量(kJ) | a | b | c | d |
| 平衡时c(SO3)(mol/L) | e | f | g | h |
科目:gzhx 来源: 题型:
在相同温度和体积均为1L的四个密闭容器中,保持温度和容积不变,以四种不同的投料进行反应。平衡时有关数据如下
(已知相同条件下:2SO2+O22SO3 △H =-196.6kJ/mol)。
| 容器 | 甲 | 乙 | 丙 | 丁 |
| 起始投入量 | 2molSO2+1molO2 | 1molSO2+0.5molO2 | 2molSO3 | 2molSO2+2molO2 |
| 反应放出或 吸收的热量(kJ) | a | b | c | d |
| 平衡时c(SO3)(mol/L) | e | f | g | h |
下列关系正确的是
A. a=c;e=g B. a>2b;e>2f C. a>d;e>h D. c+98.3e=196.6
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:
| C2(NO2) |
| C(N2O2) |
| C2(NO2) |
| C(N2O2) |
科目:gzhx 来源: 题型:
 如图所示,向A中充入1mol X和1mol Y,向B中充入2molX和2molY,起始VA=VB=aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应:X(g)+Y(g)⇌2Z(g)+W(g)△H>0;达到平衡时,VA=1.2aL,则下列说法错误的是( )
如图所示,向A中充入1mol X和1mol Y,向B中充入2molX和2molY,起始VA=VB=aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应:X(g)+Y(g)⇌2Z(g)+W(g)△H>0;达到平衡时,VA=1.2aL,则下列说法错误的是( )科目:gzhx 来源: 题型:阅读理解
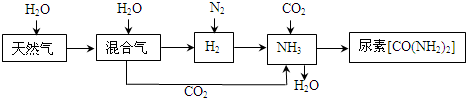
| ||
| ||
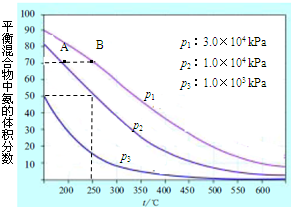
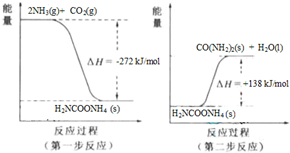
科目:gzhx 来源: 题型:
 (2009•潍坊一模)下列表格中的各种情况,可以用下面的图象曲线表示的是( ) (2009•潍坊一模)下列表格中的各种情况,可以用下面的图象曲线表示的是( )
|
科目:gzhx 来源: 题型: