
题目列表(包括答案和解析)
Ⅰ. (3分)下列实验操作不正确的是______________________。
A.在催化剂存在的条件下,苯和溴水发生反应可生成无色比水重的液体溴苯
B.将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,完成乙醇氧化为乙醛的实验
C.乙醇中含有少量水可加入生石灰再蒸馏制得无水乙醇
D.向试管中先加入一定量浓硫酸,再依次加入适量冰醋酸、无水乙醇,然后加热制取乙酸乙酯
E.实验室制取乙烯时,放入几片碎瓷片,以避免混合液在受热沸腾时剧烈跳动
F.配制银氨溶液时,将稀氨水慢慢滴入硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
 G.验证溴乙烷水解产物时,将溴乙烷和氢氧化钠溶液混合,充分振荡、静置,待液体分层后,滴加硝酸银溶液
G.验证溴乙烷水解产物时,将溴乙烷和氢氧化钠溶液混合,充分振荡、静置,待液体分层后,滴加硝酸银溶液
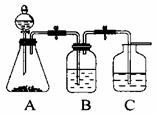
Ⅱ.(5分) 设计一个简单的一次性完成实验的装置图,验证醋酸溶液,
二氧化碳水溶液,苯酚溶液的酸性强弱顺序是CH3COOH>H2CO3>C6H5OH。
(1)装置B中盛放的试剂是 ,它的作用是 。
(2)实验中观察到C中出现的主要现象是 。
发生反应的离子方程式为: 。
某研究性学习小组的同学为验证浓硫酸与铜能反应而稀硫酸不能,设计了如图所示装置进行探究:将6.4 g 铜片和含0.2 moL溶质的18.4 mol/L浓硫酸放在圆底烧瓶中共热,直到无气体生成为止。(假定在此过程溶液体积不变)

(1)甲同学认为要证实上述结论,还应进行稀硫酸与铜片混合加热实验,你认为有无必要,并说明理由:________________
(2)下列试剂中能够用来进一步证明反应结束后的烧瓶中确有余酸的是:_____
A.铁粉 ?????? B.钠 ???? ?? C.氯化钡溶液 ???????? D.银粉
(3)为定量测定余酸的物质的量浓度,甲、乙两位同学进行了如下设计:
Ⅰ甲同学设想:在A装置增加一个导管通氮气驱赶气体(假定生成的气体全部逸出),先测定生成的SO2的量,然后计算剩余硫酸的浓度。他设计了如下二种方案来测定SO2的量:
方案① 将产生的气体缓缓通入足量用稀硫酸酸化的KMnO4溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀。
方案② 将气体缓缓通入足量硝酸钡溶液中,然后过滤、洗涤、干燥、称量沉淀。
经仔细分析后,发现有不合理之处,请填写下表(可以不填满):
序号 | 不合理的原因 | 误差 (偏低或偏高) | 改变措施 |
方案① |
|
|
|
方案② |
|
|
|
Ⅱ乙学生设计的方案是:分离出反应后的溶液并加蒸馏水稀释至1000 mL,取20.00 mL于锥形瓶中,滴入2~3滴酚酞指示剂,用标准NaOH溶液进行滴定(已知氢氧化铜开始沉淀的pH约为5),这种方法能否求出余酸的浓度,理由是_______________________________________。
(4)请再设计其他可行的实验方案,来测定余酸的物质的量浓度,简要写出操作步骤及需要测定的数据(不必计算,不必写操作细节)_____________________________________________________。
某研究性学习小组的同学为验证浓硫酸与铜能反应而稀硫酸不能,设计了如图所示装置进行探究:将6.4 g铜片和含0.2 moL溶质的18.4 mol/L浓硫酸放在圆底烧瓶中共热,直到无气体生成为止。(假定在此过程溶液体积不变)
(1)甲同学认为要证实上述结论,还应进行稀硫酸与铜片混合加热实验,你认为有无必要,并说明理由:________________
(2)下列试剂中能够用来进一步证明反应结束后的烧瓶中确有余酸的是:_____
| A.铁粉 | B.钠 | C.氯化钡溶液 | D.银粉 |
| 序号 | 不合理的原因 | 误差 (偏低或偏高) | 改变措施 |
| 方案① | | | |
| 方案② | | | |

| A.铁粉 | B.钠 | C.氯化钡溶液 | D.银粉 |
| 序号 | 不合理的原因 | 误差 (偏低或偏高) | 改变措施 |
| 方案① | | | |
| 方案② | | | |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com