
题目列表(包括答案和解析)
下列结论正确的是
①微粒半径: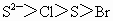 ②氢化物的稳定性:
②氢化物的稳定性: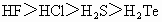 ③离子的还原性:
③离子的还原性: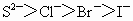 ④氧化性:
④氧化性: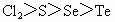 ⑤最高价含氧酸酸性:
⑤最高价含氧酸酸性: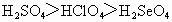 ⑥非金属性:F>Cl>S>Se
⑥非金属性:F>Cl>S>Se
[ ]
下列结论正确的是
①微粒半径: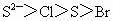 ②氢化物的稳定性:
②氢化物的稳定性: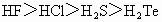 ③离子的还原性:
③离子的还原性: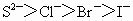 ④氧化性:
④氧化性: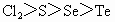 ⑤最高价含氧酸酸性:
⑤最高价含氧酸酸性: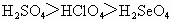 ⑥非金属性:F>Cl>S>Se
⑥非金属性:F>Cl>S>Se
[ ]
| A、固体碘化铵一定完全分解 | B、当固体碘化铵物质的量增大一倍,则在相同条件下,容器内压强也增大一倍 | C、平衡时HI分解率为40% | D、平衡时C(NH3)=5mol/L |
| A、根据元素分析结果推测该粉末为纯净物 | B、将粉末溶于水,加入氯化钡,有白色沉淀生成,证明原粉末是K2SO4 | C、将粉末加入盐酸中,产生气泡,证明原粉末是K2SO3 | D、将粉末溶于水,加入氯化钡和过量的盐酸,有白色沉淀和气泡生成,证明原粉末是K2SO4和K2SO3的混合物 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com