
(2011?泰州一模)某化学研究性学习小组为探究某品牌花生油中不饱和脂肪酸的含量,进行了如下实验:
步骤Ⅰ:称取0.4g花生油样品,置于两个干燥的碘瓶(如图)内,加入10mL四氯化碳,轻轻摇动使油全部溶解.向碘瓶中加入25.00mL含0.01mol IBr的无水乙酸溶液,盖好瓶塞,在玻璃塞与瓶口之间滴加数滴10%碘化钾溶液封闭缝隙,以免IBr的挥发损失.
步骤Ⅱ:在暗处放置30min,并不时轻轻摇动.30min后,小心地打开玻璃塞,用新配制的10%碘化钾10mL和蒸馏水50mL把玻璃塞和瓶颈上的液体冲洗入瓶内.
步骤Ⅲ:加入指示剂,用0.1mol?L
-1硫代硫酸钠溶液滴定,用力振荡碘瓶,直至终点.
测定过程中发生的相关反应如下:
①

②IBr+KI=I
2+KBr
③I
2+2S
2O
32-=2I
-+S
4O
62-请回答下列问题:
(1)已知卤素互化物IBr的性质与卤素单质类似,实验中准确量取IBr溶液应选用的仪器是
酸式滴定管(或移液管 )
酸式滴定管(或移液管 )
,碘瓶不干燥会发生反应的化学方程式
IBr+H2O=HIO+HBr
IBr+H2O=HIO+HBr
.
(2)步骤Ⅱ中碘瓶在暗处放置30min,并不时轻轻摇动的原因是
碘瓶置于暗处可减少溴化氢挥发,不断搅动可以让物质间充分反应
碘瓶置于暗处可减少溴化氢挥发,不断搅动可以让物质间充分反应
.
(3)步骤Ⅲ中所加指示剂为
淀粉溶液
淀粉溶液
,滴定终点的现象
溶液由蓝色恰好变为无色且30秒内不变化
溶液由蓝色恰好变为无色且30秒内不变化
.
(4)反应结束后从液体混合物中回收四氯化碳,所需操作有
分液、蒸馏
分液、蒸馏
.

 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下: +Br2
+Br2 +HBr
+HBr +Br2
+Br2 +HBr
+HBr (2011?泰州一模)某化学研究性学习小组为探究某品牌花生油中不饱和脂肪酸的含量,进行了如下实验:
(2011?泰州一模)某化学研究性学习小组为探究某品牌花生油中不饱和脂肪酸的含量,进行了如下实验:
 某学生查阅资料得知溴乙烷的物理性质与制取方法如下表:
某学生查阅资料得知溴乙烷的物理性质与制取方法如下表: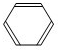 +Br2
+Br2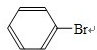 +HBr
+HBr +Br2
+Br2 +HBr
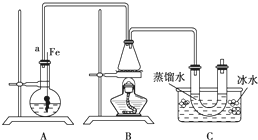
+HBr 溴苯是一种用来合成医药、农药的重要原料,某化学课外活动小组用如图装置制取溴苯.先向分液漏斗中加入苯和液溴,在A下端活塞关闭的前提下,再将混合液慢慢滴入反应器A中.
溴苯是一种用来合成医药、农药的重要原料,某化学课外活动小组用如图装置制取溴苯.先向分液漏斗中加入苯和液溴,在A下端活塞关闭的前提下,再将混合液慢慢滴入反应器A中.