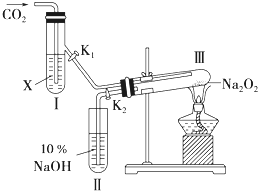
如图所示,“二氧化碳是否在有水存在时,才能与过氧化钠反应?”这个问题可通过以下实验加以证明.
(1)按图装置,在干燥的试管Ⅲ中装入Na
2O
2后,在通入CO
2之前,应事先将活塞(K
1、K
2)关闭好,目的何在?
以防止试管Ⅲ内的过氧化钠和外界相通时发生吸潮现象
以防止试管Ⅲ内的过氧化钠和外界相通时发生吸潮现象
.
(2)试管I内的试剂X是
浓H2SO4
浓H2SO4
时,打开活塞K
1、K
2,加热试管Ⅲ约5分钟后,将带火星的小木条插入试管Ⅱ的液面上,可观察到带火星的小木条不能剧烈地燃烧起来,且Ⅲ内淡黄色粉末未发生变化.则所得的结论是
过氧化钠与干燥的CO2不反应
过氧化钠与干燥的CO2不反应
.
(3)试管I内试剂为CO
2饱和水溶液时,其他操作同(2),通过
带火星的小木条在试管Ⅱ的液面上复燃,同时,Ⅲ内固体由淡黄色变为白色
带火星的小木条在试管Ⅱ的液面上复燃,同时,Ⅲ内固体由淡黄色变为白色
的现象,可以证明Na
2O
2与潮湿的CO
2能反应且放出O
2.
(4)CO
2与过氧化钠反应机理也可用示踪原子分析加以证明,请完成下列反应方程式:
2
2
Na
2O
2+
2
2
C
18O
2+
2
2
H
O-→
2Na2C18O3+O2↑+2H2O
2Na2C18O3+O2↑+2H2O
.

 如图所示,“二氧化碳是否在有水存在时,才能与过氧化钠反应?”这个问题可通过以下实验加以证明.
如图所示,“二氧化碳是否在有水存在时,才能与过氧化钠反应?”这个问题可通过以下实验加以证明.