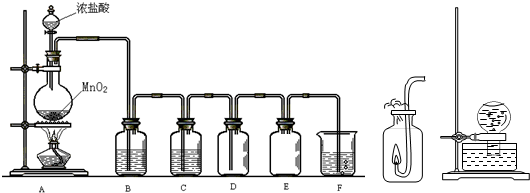
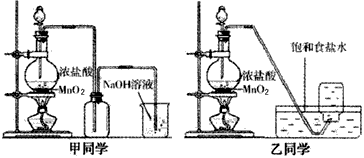
在实验室中用下列装置进行有关实验探究.请回答下列问题:
Ⅰ.气体制备时需检查装置的气密性,如下图所示各装置,肯定不符合气密性检查要求的是______.

Ⅱ.若用下列装置③制取并收集干燥的NH
3,烧瓶内装的试剂是______.收集装置应选择
______(填装置序号).证明氨气已收集满的操作是______.

Ⅲ.二氯化二硫(S
2Cl
2)在工业上用于橡胶的硫化.为在实验室合成S
2Cl
2,某化学研究性学习小组查阅了有关资料,得到如下信息:
①将干燥的氯气在110℃~140℃与硫反应,即可得S
2Cl
2粗品.
②有关物质的部分性质如下表:
| 物质 |
熔点/℃ |
沸点℃ |
化学性质 |
| S |
112.8 |
444.6 |
略 |
| S2Cl2 |
-77 |
137 |
遇水生成HCl,SO2,S;300℃以上完全分解;
S2Cl2+Cl22SCl2 |
设计实验装置图如下:
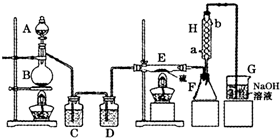
(1)B中反应的离子方程式:______;
(2)H中冷水的方向为______进______出.
(3)为了提高S
2Cl
2的纯度,关键的操作是控制好温度和______.
(4)尾气处理装置存在明显的缺陷,如何改正:______.