我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务.
(1)被称作海洋元素的是
Br
Br
(写元素符号).
(2)工业上常以食盐为原料制备氯气,再用氯气制备漂白粉,请写出漂白粉长期露置在空气中失效的化学方程式
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
,
.
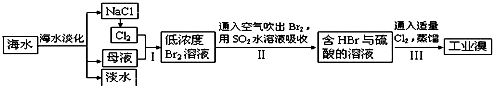
(3)从海水中提取食盐和溴的过程如下:
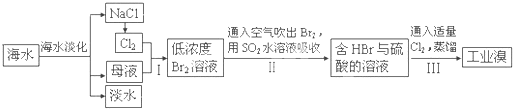
Ⅰ.①步骤Ⅰ中已获得Br
2,步骤Ⅱ中又将Br
2还原为Br?,其目的为富集溴元素,请写出步骤Ⅱ的化学方程式:
SO2+Br2+2H2O═4H++2Br-+SO42-
SO2+Br2+2H2O═4H++2Br-+SO42-
.
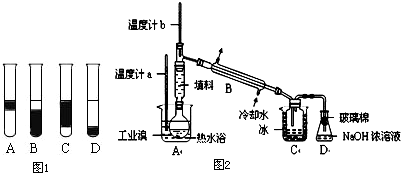
②在3mL溴水中,加入1mL四氯化碳,振荡、静置后,观察到试管里的分层现象为图1中
D
D
.
Ⅱ.某化学研究性学习小组为 了解从工业溴中提纯溴的方法,查阅了有关资料,Br
2的沸点为59℃.微溶于水,有毒性和强腐蚀性.他们参观生产过程后,设计了如装置简图2:
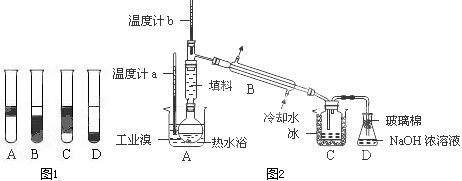
请你参与分析讨论:
①实验装置气密性良好,要在C中获得纯净的液溴即达到提纯溴的目的,操作中控制的关键条件是:
控制温度计b的温度,并收集59℃时的馏分
控制温度计b的温度,并收集59℃时的馏分
.
②为除去该产物中仍残留的少量Cl
2,可向其中加入
NaBr
NaBr
溶液,充分反应后,再进行的分离操作是
萃取分液
萃取分液
.