
题目列表(包括答案和解析)

(1)填表
|
装 置 |
现 象 |
化学方程式 |
|
① |
|
|
|
③ |
|
|
|
④ |
|
|
|
⑤ |
|
|
(2)假设每一步反应中,气态物质都完全作用,那么最后出来的气体是
根据提供的数据或有关符号填表:
粒子符号 ![]() Cl- Mn+ Rm-
Cl- Mn+ Rm- ![]()
![]() Na2O2
Na2O2
核电荷数
质子数 1
中子数 0 18 n
电子数 0 y
质量数
工业制碱纯碱,是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,它的反应原理可用下列化学方程式表示:
NH3+CO2+H2O=NH4HCO3 ①
NH4HCO3+NaCl(饱和)=HaHCO3↓+NH4Cl ②
将所得碳酸氢钠晶体加热分解后即可得到纯碱.
请回答:
(1)工业所制纯碱中常含有少量的氯化钠杂质,其原因是________.
(2)现有甲、乙、丙三个小组的学生,欲测定某工业纯碱样品中Na2CO3的质量分数,分别设计并完成实验如下.
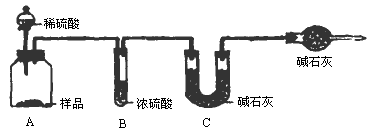
甲组:取10.00g样品,利用上图所示装置,测出反应后装置C中碱石灰的增重为3.52g.
乙组:取10.00g样品,配成1000mL溶液,用碱式滴定管量取25.00mL放入锥形瓶中,加入甲基橙作指示剂,用0.150mol·L-1的标准盐酸溶液滴定至终点(有关反应为Na2CO3+2HCl=2NaCl+2H2O+CO2↑).完成三次平行实验后,消耗盐酸体积的平均值为30.00mL.
丙组:取10.00g样品,向其中加入过量的盐酸,直至样品中无气泡冒出,加热蒸发所得物并在干燥器中冷却至室温后称量.反复加热、冷却、称量,直至所称量的固体质量几乎不变为止,此时所得固体的质量为10.99g.请分析、计算后填表:

某课外活动小组设计了如下图的实验:
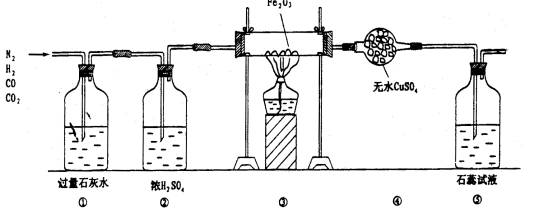
(1)填表
|
装 置 |
现 象 |
化学方程式 |
|
① |
|
|
|
③ |
|
|
|
④ |
|
|
|
⑤ |
|
|
(2)假设每一步反应中,气态物质都完全作用,那么最后出来的气体是
如图所示,在一个烧瓶中充满气体A,打开①处的止水夹并向烧瓶中缓慢通入等体积的气体B后关闭该止水夹,待充分反应后再打开②处的止水夹。
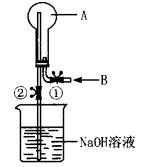
(1)请按要求填表回答打开②处的止水夹前后烧瓶中所观察到的现象并按要求书写反应的化学方程式:
实验序号 气体A 气体B 现象 A与B反应的化学方程式
打开②处止水夹前 打开②处止水夹后
① SO2 H2S
② NH3 HCl
③ O2 NO
(2)分别完成以上三个实验,烧瓶内剩余气体最多的是(填实验序号)________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com